Reflexões e estratégias da sociedade civil
O presente artigo aborda o sistema de proteção à propriedade industrial vigente no Brasil e sua relação com a política de acesso universal a medicamentos para tratamento da AIDS. Ainda, apresenta as principais estratégias de atuação de um grupo da sociedade civil brasileira - GTPI/REBRIP – em relação aos principais problemas e desafios identificados.
A política de acesso universal ao tratamento anti-retroviral no Brasil tem mostrado importantes resultados. Entre 1997 e 2004, houve uma redução de 40% na mortalidade e de 70% na morbidade; entre 1993 e 2003, observou-se um aumento de cerca de cinco anos na idade mediana dos óbitos por AIDS, refletindo um aumento na sobrevida dos pacientes.1 Além disso, houve uma redução das hospitalizações em 80%, gerando uma economia de gastos da ordem de US$ 2,3 bilhões.2
Estes dados demonstram que, nos últimos dez anos, o acesso a tratamento anti-retroviral (ARV) adequado transformou substancialmente a vida dos pacientes e os métodos de controle da infecção determinada pelo HIV, aumentando a qualidade de vida das pessoas que vivem com AIDS, aumentando a expectativa de vida, reduzindo a transmissibilidade do vírus, e causando uma queda significativa nos índices de mortalidade. Daí a importância em se assegurar acesso universal ao tratamento a todos aqueles que dele necessitam.
Segundo estimativas da Organização Mundial de Saúde – OMS, cerca de 6,5 milhões de pessoas, nos países pobres e em desenvolvimento, precisam urgentemente de tratamento ARV. Entretanto, devido principalmente à proteção patentária dos medicamentos e dos elevados preços praticados pelas empresas fabricantes, apenas 1,3 milhões de pessoas têm condições de receber o tratamento. Cerca de 80% das 3 milhões de pessoas que morrem anualmente em decorrência da AIDS não tiveram acesso ao tratamento medicamentoso disponível.3
O Brasil é um dos poucos países do mundo que mantém uma política de acesso universal e gratuito para tratamento da Aids. De acordo com dados do Programa Nacional de DST/AIDS, estima-se que há no Brasil 546 mil pessoas infectadas com o vírus HIV. Destas, 180 mil utilizam medicamentos ARV para tratamento da doença.4 O orçamento total do Ministério da Saúde para a compra de medicamentos anti-retrovirais em 2007 foi de R$ 984.000.000,00.5 Estima-se que mais de 80% deste valor é utilizado para a aquisição de 11 medicamentos patenteados e 20% para a compra de 7 medicamentos fabricados por laboratórios nacionais.6
Esta enorme proporção do orçamento a ser gasto com medicamentos patenteados tem colocado em risco a sustentabilidade e a universalidade deste programa de atenção à saúde.7
O acesso a tratamento adequado é condição essencial para que milhares de pessoas que vivem com AIDS no Brasil possam ter uma vida com mais dignidade. O governo brasileiro tem a obrigação legal de fornecer tratamento a todos aqueles que dele necessitam. O sucesso do Programa Nacional deveu-se num primeiro momento à fabricação nacional de medicamentos que são utilizados no tratamento e que não gozam de proteção patentária no país. A importação de uma gama cada vez maior de medicamentos ARV patenteados ou em vias de patenteamento no Brasil podem tornar insustentável a política de acesso universal e gratuito ao tratamento da AIDS no país.
A implementação da política de tratamento universal esteve inserida em um contexto histórico favorável em virtude do processo de re-democratização do país, intensificado a partir de 1985. Esse processo levou a re-fundação da estrutura constitucional a partir da promulgação da nova Constituição da República Federativa do Brasil de 1988.8
No caso da saúde, o “Movimento Sanitário” – originário da década de 1970 e composto inicialmente por profissionais e estudantes de saúde – teve papel fundamental no reconhecimento constitucional de que “saúde é direito de todo cidadão e dever do Estado” (artigo 196, Constituição Federal),9 fornecendo as bases fundamentais para a construção de um sistema público de saúde. A partir de então, apresentou-se o desafio de desenvolver um sistema público de saúde obedecendo a princípios fundamentais como a universalidade, a integralidade e a igualdade de acesso aos serviços de saúde em todos os níveis de assistência – sem preconceitos ou privilégios de qualquer espécie. Assim, foi criado o Sistema Único de Saúde (SUS), regulamentado por meio das Leis 8.080/90 e 8.142/90. Ressalta-se que entre os campos de atuação do SUS está a assistência terapêutica integral, incluindo a farmacêutica, o que implica a obrigação de o Estado fornecer medicamentos para todos aqueles que deles necessitem.
Em relação ao enfrentamento da epidemia de HIV/AIDS no país, o primeiro programa oficial foi implantado em São Paulo, em 1983, caracterizado pela participação da comunidade gay organizada junto aos técnicos da Secretaria Estadual de Saúde. Na busca de uma resposta de âmbito nacional, o Estado brasileiro criou o Programa Nacional de Aids em 1986.10
Em 1985 e 1986 surgiram as primeiras organizações não governamentais (ONGs) voltadas para o enfrentamento da epidemia: Grupo de Apoio a Prevenção da AIDS (GAPA) em São Paulo e Associação Brasileira Interdisciplinar de AIDS (ABIA), no Rio de Janeiro. A partir de então foram desenvolvidas várias campanhas de prevenção e iniciativas de luta contra a discriminação e o preconceito, bem como a busca pela solidariedade.11 A busca por tratamento também se tornou uma demanda crescente.
O primeiro medicamento para o tratamento da AIDS foi a zidovudina (AZT), inicialmente aprovado para essa indicação em 1987, pela agência reguladora de medicamentos e alimentos estadunidense (FDA). A sua disponibilização pelo Ministério da Saúde brasileiro foi efetivada em 1991. Paralelamente ao início da utilização em larga escala do AZT no Brasil, as empresas farmacêuticas transnacionais lançaram novos medicamentos para o controle da AIDS. A monoterapia com AZT passou a ser considerada ineficiente, marcando o início da recomendação de terapia combinada (conhecida como “coquetel”) em nível internacional.12
Diante das novas formas de tratamento, muitos médicos começaram a prescrever esquemas ainda não incorporados nas recomendações oficiais do sistema de saúde brasileiro. O ritmo desigual entre o surgimento de novos produtos, a incorporação no âmbito do sistema público de saúde e a necessidade imediata de novos esquemas para alguns indivíduos já intolerantes aos existentes levaram à busca por soluções na esfera judicial para a viabilização do acesso aos medicamentos demandados.
A partir de 1996, as primeiras ações judiciais de garantias individuais, reivindicando os medicamentos mais novos, começaram a ser ajuizadas, alcançando-se decisões favoráveis aos pacientes. Os principais argumentos utilizados incluíam as normas dispostas na Constituição Federal, na Lei Orgânica de Saúde 8.080/90 e nas Constituições Estaduais, sempre ressaltados os direitos à saúde e à vida.13
Ainda em 1996, em ambiente de forte mobilização social e demanda da Coordenação Nacional de AIDS, foi aprovada a Lei 9.313 – também conhecida como Lei Sarney –, fortalecendo o marco legal já existente para a garantia do acesso a ARVs. A aprovação desta lei foi determinante para a melhor estruturação do Programa Nacional de AIDS no que se refere à compra de medicamentos.
Muito embora não se possa afirmar que as ações judiciais de garantia a medicamentos tenham sido determinantes para a aprovação da Lei 9.313/96, pode-se pelo menos avaliar que o fato das assessorias jurídicas de ONGs/AIDS estarem ativas na luta pela efetivação dos compromissos legais de direito à saúde constituiu parte do ambiente favorável à aprovação da lei. Ou seja, o exercício de um direito por parte do cidadão pode ter contribuído para a estruturação e melhor organização das respostas governamentais. O processo contínuo de construção e implementação da política de acesso a ARVs no país teve como importante componente impulsionador a mobilização da sociedade civil também na esfera judicial.
Outro fator de fundamental importância para a implementação da política universal foi a possibilidade de produzir localmente – por laboratórios públicos e privados nacionais – os medicamentos ARVs a preços inferiores aos oferecidos pelas empresas transnacionais. No início da década de 1990, a produção desses produtos começou a ser realizada porque a lei de propriedade industrial então vigente (Lei 5.772/71) não incluía o reconhecimento de patentes para produtos e processos farmacêuticos.
No entanto, ainda em 1996, no mesmo ano da aprovação da Lei Sarney, também foi aprovada no país a nova Lei de Propriedade Industrial (Lei 9.279/96), que modificaria amplamente o cenário que se tinha construído até então, com a viabilização do acesso a medicamentos por meio da produção local a preços acessíveis. A obrigatoriedade de se conceder patentes para o setor farmacêutico – imposta por acordos internacionais – mudaria completamente este cenário, dificultando muito a política de acesso universal vigente no Brasil.
A nova lei brasileira de propriedade industrial buscava adequar-se às regras de direito internacional estabelecidas no âmbito da Organização Mundial do Comércio – OMC, criada em dezembro de 1994. Os Estados Membros assinaram uma série de acordos multilaterais, dentre os quais o Acordo sobre os Aspectos dos Direitos de Propriedade Intelectual Relacionados ao Comércio (Acordo TRIPS ou Acordo ADPIC), o qual estabeleceu a obrigatoriedade de reconhecimento da propriedade intelectual para todos os campos tecnológicos, incluindo o setor farmacêutico.
Dessa forma, os países tiveram que modificar suas legislações nacionais para se adequarem ao TRIPS, o que representou para muitos o reconhecimento de campos tecnológicos não desenvolvidos internamente e um fortalecimento da reserva de mercado das empresas transnacionais com sedes nos países desenvolvidos. No caso dos medicamentos, componente essencial para a garantia do direito à saúde, o TRIPS passou a tratá-los como qualquer outra mercadoria, trazendo prejuízos e barreiras importantes para a implementação de políticas de saúde, conforme será exposto adiante.
Como visto, com a criação da OMC em 1994 e com a assinatura do Acordo TRIPS, todos os países membros da Organização foram obrigados a alterar suas legislações nacionais e reconhecer um padrão mínimo de proteção à propriedade intelectual em todos os campos tecnológicos, inclusive o farmacêutico. No entanto, o Acordo TRIPS concedeu prazo para que os países em desenvolvimento e países de menor desenvolvimento relativo que não reconheciam patentes para alguns campos tecnológicos – como produtos e processos farmacêuticos – passassem a fazê-lo. Os países em desenvolvimento teriam até 2005 para incorporar o padrão mínimo de proteção em suas legislações internas e os países menos desenvolvidos teriam até 2016, conforme previsto na Declaração de Doha sobre o Acordo TRIPS e Saúde Pública, assinada em 2001.
O sistema de proteção patentária instituído pelo Acordo TRIPS possui como objetivo a promoção da inovação tecnológica e a transferência e difusão de tecnologia, de forma conducente ao bem-estar social e econômico (Artigo 7) e permite que os Membros possam adotar medidas necessárias para proteger a saúde pública e para promover o interesse público em setores de importância vital para seu desenvolvimento econômico e tecnológico (Artigo 8).
Assim, o Acordo TRIPS permite que os países membros incluam em suas legislações algumas flexibilidades ou salvaguardas que possam garantir proteção para a saúde pública. As principais flexibilidades previstas no Acordo TRIPS são: licença compulsória (Artigo 31), importação paralela (Artigo 6), uso experimental (Artigo 30), exceção Bolar (Artigo 30) e atuação do setor saúde nos processos de pedidos de patentes farmacêuticas (implícita no Artigo 8), que serão melhor analisadas neste artigo.
No entanto, o Brasil não aproveitou o período de transição de 10 anos que foi dado pela OMC para reconhecer patentes na área de medicamentos. Este período foi oferecido aos países em desenvolvimento que não reconheciam patentes nesta área. Uma das principais vantagens desse período seria permitir o fortalecimento dos laboratórios nacionais para enfrentar a concorrência com as empresas transnacionais de medicamentos intensivas em Pesquisa e Desenvolvimento (P&D). O Brasil utilizou o período de transição por menos de dois anos, tendo alterado sua lei em 1996, com aplicação a partir de maio de 1997.14 Além disso, a legislação brasileira deixou de adotar algumas das flexibilidades permitidas pelo TRIPS e, em alguns aspectos, foi além do requerido pelo Acordo.
Desde então, diferentes desafios surgiram para a manutenção da política de acesso universal a medicamentos. O maior desses desafios foi o aumento no custo do tratamento devido à utilização de novos medicamentos sujeitos à proteção patentária e não produzidos nacionalmente. Esses novos medicamentos foram sendo recomendados pelo consenso terapêutico para substituir ou complementar protocolos de tratamento anteriores. Além disso, houve também um aumento do número de pacientes em tratamento.
A lei de patentes brasileira (LPI) incluiu algumas das flexibilidades do Acordo TRIPS que são de interesse para a saúde pública (Quadro 1). As flexibilidades são dispositivos que visam mitigar os efeitos perversos dos direitos conferidos ao detentor da patente, buscando restabelecer o equilíbrio entre direitos da propriedade intelectual e direito de acesso ao conhecimento.
No caso da saúde, as flexibilidades visam a dois alvos, um mais imediato e outro de médio e longo prazo. A licença compulsória, a importação paralela e a exceção Bolar são flexibilidades cujo alvo é imediato, isto é, a obtenção de medicamentos a preços mais razoáveis, seja por meio da entrada de versões genéricas de medicamentos, seja por meio da importação de produtos que estejam sendo comercializados internacionalmente a preços inferiores aos praticados no país.
A licença compulsória foi incorporada pela legislação brasileira e pode ser concedida sob diversos fundamentos. O artigo 68 da legislação brasileira de patentes prevê que o titular ficará sujeito a ter a patente licenciada compulsoriamente se exercer os direitos dela decorrentes de forma abusiva ou por meio dela praticar abuso de poder econômico. O mesmo dispositivo estabelece ainda que uma licença compulsória poderá ser também concedida em caso de não exploração do objeto da patente no território brasileiro ou quando a comercialização do produto patenteado não satisfizer às necessidades do mercado. Poderá haver licenciamento compulsório ainda em casos de patentes dependentes, nos termos previstos no artigo 70 da LPI. Por fim, o artigo 71 prevê que poderá ser concedida uma licença compulsória em casos de emergência nacional ou interesse público declarados em ato do Poder Executivo Federal.
A exceção Bolar, por sua vez, foi incorporada por uma emenda à lei de propriedade industrial, feita pela Lei nº 10.196/2001, que incluiu o inciso VII no artigo 43. O uso desta flexibilidade tem dupla vantagem para o país: além de favorecer a rápida entrada do medicamento genérico no mercado, possibilita o aprendizado pelo uso da informação sobre a invenção.
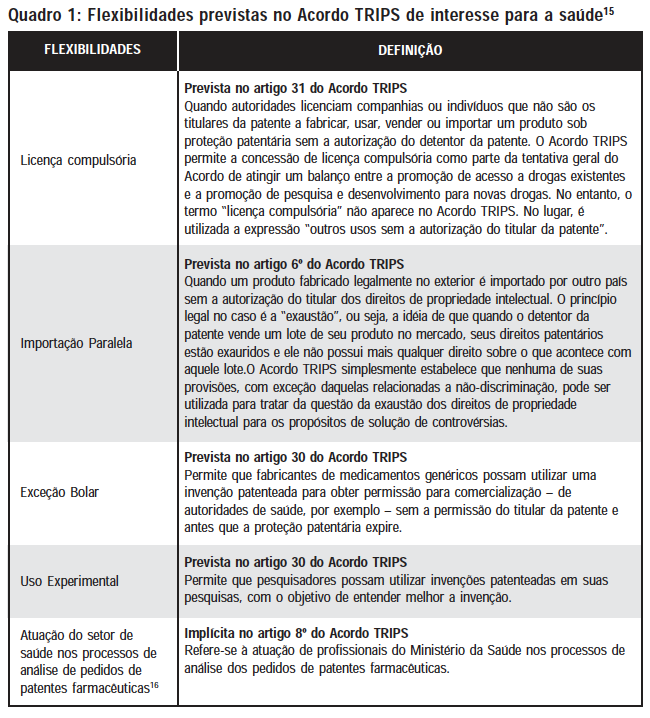
A importação paralela foi também incorporada, porém de forma muito limitada, uma vez que sua utilização está condicionada às situações de concessão de licença compulsória por razão de abuso do poder econômico (art.68, §§ 3º e 4º, LPI). Há um projeto de lei (PL 139/99) tramitando no Congresso Nacional para incorporação desta flexibilidade de forma plena. Para as políticas de acesso a medicamentos, esta flexibilidade é extremamente importante, pois as empresas farmacêuticas multinacionais costumam estabelecer preços diferenciados para um mesmo medicamento nos diferentes países. Assim, a existência da importação paralela nas legislações nacionais permite que um país importe um medicamento de onde ele esteja sendo comercializado ao menor preço.17
O uso experimental e a atuação do setor saúde nos processos de pedidos de patentes farmacêuticas são flexibilidades cujo alvo é de médio e longo prazo, pois visam a estimular o desenvolvimento tecnológico nacional, por meio do aproveitamento do conhecimento disponibilizado pela patente e impedir que sejam concedidos direitos de exclusividade àqueles pedidos que não atendam aos requisitos legais de patenteabilidade.
O uso experimental é permitido no Brasil e está previsto no artigo 43, II da LPI. Representa uma das formas de se promover um equilíbrio entre os interesses do detentor da patente e os interesses nacionais, porque possibilita a utilização da informação revelada pela patente com o objetivo de promover o desenvolvimento científico e tecnológico do país. Esta investigação científica pode ser realizada por qualquer laboratório de pesquisa, seja ele público ou privado.18
A atuação do setor de saúde no processo de concessão de patentes farmacêuticas foi incorporada pela Lei 10.196/2001, que incluiu o artigo 229c na legislação brasileira de propriedade intelectual. Este dispositivo determinou que a concessão de patentes nesta área somente poderia ser concedida com a anuência prévia da Agência Nacional de Vigilância Sanitária (ANVISA), órgão responsável pela segurança sanitária e pela garantia da qualidade dos medicamentos no país.
Devido à importância do tema e a essencialidade dos produtos farmacêuticos, o legislador brasileiro entendeu que matéria de tal importância mereceria o exame mais cuidadoso e tecnicamente competente possível que o Estado brasileiro pudesse dispor. O papel da ANVISA na anuência prévia não é, assim, o de simples interferência no processo de concessão de patentes. Trata-se de uma medida para proteção dos pacientes, evitando-se que seja concedida uma patente imerecida.19
A anuência prévia está em perfeita consonância com o Acordo TRIPS, que em seu artigo 8º admite que cada membro, ao formular suas leis nacionais, pode adotar medidas que sejam necessárias para a proteção da saúde e promoção do interesse público em setores de vital importância para seu desenvolvimento sócio-econômico e tecnológico, como o é o setor de assistência farmacêutica.
Muito embora essas flexibilidades estejam incorporadas na legislação brasileira e sejam compatíveis com as regras internacionais que regem a matéria, a utilização de flexibilidades, que visam à entrada de medicamentos a preços acessíveis no curto prazo, tem sido bastante limitada, não apenas no Brasil, mas também em quase todos os países em desenvolvimento. Recentemente, alguns países em desenvolvimento fizeram uso destas medidas, especialmente a licença compulsória, como forma de aumentar o acesso a tratamento, como foi o caso da Tailândia20,21 e também do Brasil em 2007.22
Na realidade, as licenças compulsórias já foram utilizadas em diversas situações e em diversos países, incluindo países desenvolvidos.23 É importante notar que apesar de serem publicamente contra a emissão de licenças compulsórias para o tratamento de doenças como a Aids, países desenvolvidos, como os Estados Unidos da América por exemplo, já fizeram uso de licenças compulsórias quando estas tinham por objetivo a garantia de seus interesses.
No Brasil, a ameaça de emissão de licença compulsória foi o principal instrumento de pressão utilizado durante os processos de negociação de preços dos medicamentos ARVs. O laboratório farmacêutico oficial da Fundação Oswaldo Cruz, chamado Instituto de Tecnologia em Fármacos ou apenas Farmanguinhos, foi capaz de subsidiar o Ministério da Saúde com as referências de preços aceitáveis e capacidade para produzir em situação de impasse e emissão da licença compulsória. As empresas preferiram reduzir os preços de seus produtos a terem-nos produzidos pela indústria nacional.24
No entanto, pelo fato de o governo brasileiro nunca ter até então emitido efetivamente a licença compulsória para a produção local de medicamentos, a estratégia de negociação de preços tornou-se ineficiente e os preços posteriormente alcançados foram insatisfatórios. Nos anos de 2004 e 2005, por exemplo, os preços dos medicamentos nelfinavir e efavirenz foram mantidos, enquanto o preço do lopinavir/ritonavir foi reduzido em 1%. Os descontos obtidos para os novos medicamentos, tenofovir e atazanavir, foram de 5,2% e 7,7%, respectivamente. Por essa razão, o gasto médio por paciente no ano de 2005 alcançou o valor de R$ 6.124,00, equiparando-se ao período de 1998.25 Essa elevação dos gastos colocou em risco a sustentabilidade do Programa Nacional de DST/AIDS.
Em 2005, durante outra negociação com a empresa Abbott para redução do preço do lopinavir/ritonavir, utilizado na época por 17.000 pessoas, o governo brasileiro deu mais um passo em direção à emissão de uma licença compulsória ao declarar, por meio de um decreto oficial, que o medicamento era de interesse público e que a empresa teria que oferecer um preço mais baixo. Após meses de negociação, o Ministro da Saúde fez um acordo com a Abbott aceitando o preço fixo de US$ 1.380 por paciente/ano até 2011, não importando o incremento da demanda ou variação internacional de preços. Além disso, o acordo também previu a garantia de que não seria emitida uma licença compulsória para este medicamento. Este acordo foi considerado por muitos grupos da sociedade civil como um péssimo acordo e claramente TRIPS-plus, uma vez que foram estabelecidas cláusulas mais restritivas do que as adotadas pelo TRIPS.26
A não emissão de uma licença compulsória neste caso levou organizações membros do Grupo de Trabalho sobre Propriedade Intelectual da Rede Brasileira pela Integração dos Povos (GTPI/REBRIP) a ajuizarem uma ação civil pública com o objetivo de compelir o governo federal a emitir uma licença compulsória para o Kaletra. Esta estratégia de atuação do GTPI/REBRIP será objeto de análise posterior no presente artigo.
A adoção da licença compulsória tem sido apoiada pela sociedade civil brasileira nos últimos anos como uma forma de superar ameaças à sustentabilidade do acesso universal a tratamento impostas pelos altos custos dos medicamentos. No entanto, esta flexibilidade só foi utilizada no Brasil em 2007, para o medicamento efavirenz. O custo por paciente/ano no Brasil era de US$ 580 desde 2003, enquanto no mercado internacional era possível encontrar preços duas vezes mais baixos. Após longa tentativa de negociação com a Merck, a única oferta realizada pela empresa foi a de reduzir os preços em 2%, oferta esta inaceitável. Por exemplo, este preço era duas vezes maior que o preço oferecido pela Merck à Tailândia, após este país ter emitido uma licença compulsória para o medicamento.
O Efavirenz foi declarado de interesse público em abril e a licença compulsória foi emitida em maio de 2007.27 Enquanto a produção local está sendo preparada por dois laboratórios públicos (Farmanguinhos e Lafepe), a versão genérica do medicamento está sendo importada da Índia desde julho de 2007 ao custo de R$ 365 paciente/ano,28 um terço do preço oferecido pela Merck.
O licenciamento compulsório revelou um compromisso governamental com a sustentabilidade do acesso ao tratamento do HIV/Aids, em um cenário em que os medicamentos sujeitos à proteção patentária apresentam preços exorbitantes e inacessíveis para a grande maioria dos países em desenvolvimento. Além disso, a possibilidade sinalizada pelo governo de fazer uso da licença compulsória para outros medicamentos29 é extremamente positiva, pois visa a assegurar a sustentabilidade não apenas do Programa Nacional DST/Aids, mas também de todo o sistema público de saúde.
Apesar de o Brasil ter adotado quase todas as flexibilidades de interesse para a saúde pública previstas no TRIPS, existem alguns problemas internos tanto na legislação sobre patentes quanto em sua implementação que podem ser prejudiciais à saúde pública. Entre eles, destacam-se os seguintes:
a) mecanismo pipeline;
b) diretrizes de exame de patentes adotadas pelo Instituto Nacional de Propriedade Industrial – INPI
c) dificuldade para implementação do papel do Ministério da Saúde no processo de análise de patentes farmacêuticas (anuência prévia);
d) medidas TRIPS-plus em votação no Congresso Nacional.
A legislação sobre propriedade intelectual no Brasil, até a alteração ocorrida em 1996, proibia a concessão de patentes para algumas áreas tecnológicas, entre elas produtos e processos farmacêuticos e alimentícios. Esta proibição foi excluída pela nova Lei de Propriedade Industrial (Lei nº 9.279/96). Essa lei reconheceu a proteção patentária para todas as áreas tecnológicas, em decorrência de exigências estipuladas no Acordo TRIPS da OMC. Esse acordo estabelece a todos os Membros da OMC a obrigatoriedade de proteção patentária a invenções de todos os setores tecnológicos.
No entanto, ao alterar sua legislação para satisfazer aos requisitos previstos no Acordo TRIPS, o Brasil foi além das obrigações assumidas em âmbito internacional e incluiu na nova legislação um mecanismo de revalidação de patentes depositadas e concedidas no exterior, conhecido comopipeline.
O mecanismo pipeline constitui uma disposição temporária por meio da qual foram aceitos depósitos de patentes em campos tecnológicos não reconhecidos até então, possibilitando a proteção patentária de produtos farmacêuticos e alimentícios, entre outros. Os pedidos de patentes pelo mecanismo pipeline estariam sujeitos apenas a uma análise formal e seguiriam os termos da patente concedida no exterior, não sendo submetidos a uma análise técnica dos requisitos de patenteabilidade – novidade, atividade inventiva e aplicação industrial – pelo escritório de patentes brasileiro (INPI).
Ainda mais grave, a proteção patentária pela via pipeline representa a concessão de privilégios a invenções que já se encontravam em domínio público. O Brasil adota o princípio da novidade absoluta em matéria de patente, ou seja, se a tecnologia para a qual se pede proteção já entrou no estado da técnica30 em qualquer lugar, em qualquer tempo, não pode ser protegida.31 As invenções protegidas pelo pipeline já se encontravam no estado da técnica, uma vez que já haviam sido publicadas no exterior. Como os pedidos de patente foram feitos no Brasil após o término do período de prioridade,32 as invenções já se encontravam em domínio público e não poderiam mais ser protegidas.
Assim, a concessão de patentes pipeline viola frontalmente o princípio da inderrogabilidade do domínio público, pelo qual um conhecimento, após ter entrado em domínio público, não pode mais dele ser retirado. O ingresso no domínio público faz com que determinado bem se torne comum a todos e a coletividade adquire o direito de mantê-lo disponível, impedindo sua apropriação individual.33
Apesar de muito confundido, o mecanismo pipeline não é igual nem equivalente ao mail-boxexistente em outros países, como na Índia, e previsto no Acordo TRIPS. O mail-box estabelece que a partir do “momento zero” do TRIPS (1995) os escritórios de patentes nacionais poderiam receber pedidos de patentes nas áreas não privilegiáveis até então e mantê-los depositados, porém esses pedidos só seriam analisados quando a lei de patentes nacional entrasse em vigor. No caso das patentes pipeline foi possível a proteção retroativa para objetos depositados ou já patenteados em outros países, dentro ou fora do período de anterioridade. Assim, permitiu-se a concessão de patentes para conhecimentos que já tinham patentes conhecidas no exterior mesmo antes do momento zero do TRIPS. Além disso, as patentes pipeline não passam por nenhuma análise técnica no escritório de patentes brasileiro.
As patentes pipeline causaram grande impacto em áreas sensíveis para o interesse social e para o desenvolvimento tecnológico e econômico do país. De acordo com os dados divulgados pelo INPI, dentro do prazo legal de um ano a contar da publicação da Lei nº 9.279/96, foram depositados 1.182 pedidos pipeline,34 dos quais mais da metade já foram concedidos e os demais estão em andamento.35
O Efavirenz, medicamento recentemente licenciado compulsoriamente, é protegido por uma patente obtida através do mecanismo pipeline. Ou seja, quando esse medicamento foi depositado no Brasil não mais atendia ao requisito de novidade (pois a informação sobre a invenção já havia sido publicada no exterior cinco anos antes).36 Este princípio ativo poderia ter sido fabricado no Brasil, tal como foi na Índia.
Outros medicamentos fundamentais para uma resposta adequada à epidemia de HIV/AIDS, como o Lopinavir/Ritonavir, abacavir, Nelfinavir e amprenavir, também foram protegidos pelo pipeline,assim como o medicamento para câncer – imatinib ou Glivec (nome comercial).
Devido ao grande impacto causado pelas patentes pipeline no Brasil, o GTPI resolveu questionar judicialmente este mecanismo de concessão de patentes. Esta ação será analisada no próximo tópico do presente artigo, quando serão abordadas as principais estratégias de atuação do GTPI.
No Brasil, o INPI, autarquia federal vinculada ao Ministério do Desenvolvimento, Indústria e Comércio Exterior, tem por finalidade executar as normas que regulam a propriedade intelectual, tendo em vista a sua função social, econômica, jurídica e técnica, de acordo com legislação de propriedade intelectual e com a Constituição Federal. Deste modo, cabe ao INPI analisar pedidos de concessão de patentes em diversas áreas do conhecimento, inclusive medicamentos.
Para a análise de pedidos de patentes de medicamentos, o INPI emitiu as “diretrizes para o exame de pedidos de patente nas áreas de biotecnologia e farmacêutica depositados após 31/12/1994”.37 Tal documento tem a função de nortear os examinadores na interpretação da Lei de patentes brasileira sobre o que deve ou não ser objeto de proteção patentária. No entanto, referidas diretrizes são mais amplas do que as regras contidas na legislação brasileira de propriedade intelectual e estão em desacordo com os objetivos visados pela Constituição Federal ao conferir proteção à propriedade intelectual (art. 5º, XXIX, CF/88), gerando a concessão de inúmeras patentes em desacordo com as regras vigentes no país.
Mencionamos alguns exemplos que ilustram o problema: a LPI não permite a proteção de meras descobertas (artigo 10) nem a proteção de pedidos que não atendam ao requisito de novidade (artigo 11). No entanto, as diretrizes do INPI incluem a possibilidade de proteger novos usos de produtos já conhecidos, possibilitando práticas conhecidas como evergreening em detrimento à proteção de reais inovações farmacêuticas. Outro exemplo claro de afronta à lei é a permissão de patenteamento de seqüências de DNA, sob a justificativa de que as mesmas são meros compostos químicos e não parte de seres vivos.
De acordo com a legislação brasileira sobre propriedade intelectual, pedidos de patentes farmacêuticas precisam obter a anuência prévia da ANVISA, tendo em vista a sua importância para a saúde pública.
O principal problema na implementação desta flexibilidade consiste no fato de que o INPI não publica as decisões da ANVISA que não concederam a anuência prévia, impedindo a finalização completa do processo que não concederá a patente. Isso significa que o pedido de patente continua pendente e o potencial detentor da patente goza de um monopólio “de facto” de qualquer jeito.
Além dos problemas acima destacados, há ainda um outro problema que deve ser enfrentado quando atuamos com o tema de propriedade intelectual no Brasil. Atualmente, estão em trâmite no Congresso Nacional diversos projetos de lei que, se aprovados, representariam a adoção de medidas TRIPS-plus na legislação brasileira.
Medidas TRIPS-plus representam formas de proteção à propriedade intelectual mais restritivas do que aquelas adotadas pelo TRIPS.38 Geralmente, estas medidas visam a privilegiar os interesses dos detentores das patentes em detrimento do interesse público. Via de regra, estas medidas são negociadas em acordos de comércio bilaterais, negociados entre países desenvolvidos e países em desenvolvimento. O Brasil não possui nenhum acordo bilateral em negociação que envolva proteção à propriedade intelectual. No entanto, estas medidas estão em votação em projetos de lei dentro do Poder Legislativo brasileiro e é preciso ficar atento para que estas medidas não sejam aprovadas. Esta é uma evidência muito simples de como as medidas TRIPS-plus podem ser implementadas nos países em desenvolvimento para além de acordos bilaterais ou regionais de livre comércio.
Exemplo disso é o Projeto de Lei 29/2006, que visa à inclusão de uma medida TRIPS-plus ao prever a vinculação entre a proteção patentária e o registro sanitário do medicamento. Se aprovado, significa que, na prática, a exceção Bolar prevista na legislação brasileira será anulada. Este caso será mais bem analisado abaixo, ao abordamos as estratégias de atuação do GTPI.
Diante da importância da manutenção de políticas públicas como a de acesso universal a tratamentos antiretrovirais e dos desafios e obstáculos impostos pelas novas regras de proteção a propriedade intelectual, grupos da sociedade civil brasileira, com apoio de organizações internacionais, resolveram unir esforços para lidar com o tema, ao mesmo tempo relevante e complexo. Assim, foi criado em 2001 o Grupo de Trabalho sobre Propriedade Intelectual da Rede Brasileira pela Integração dos Povos (GTPI/REBRIP).
A REBRIP é uma articulação de ONGs, movimentos sociais, entidades sindicais e associações profissionais autônomas e pluralistas, que atuam sobre os processos de integração regional e comércio, comprometidas com a construção de uma sociedade democrática pautada em um desenvolvimento econômico, social, cultural, ético e ambientalmente sustentável. Estas entidades buscam alternativas de integração opostas à lógica da liberalização comercial e financeira predominante nos acordos econômicos atualmente em curso.39
Devido à crescente discussão sobre propriedade intelectual no âmbito internacional e o impacto causado pelos acordos internacionais no âmbito nacional, demonstrou-se necessária a criação de um grupo destinado à discussão de temas tocantes à propriedade intelectual e sua repercussão no acesso ao conhecimento pela sociedade brasileira. Neste contexto, foi criado o GTPI, coordenado pela Associação Brasileira Interdisciplinar de AIDS – ABIA desde a sua criação em 2001 (tendo sido reconduzida à coordenação nas duas últimas assembléias da REBRIP). O GTPI é composto por diversas organizações da sociedade civil brasileira e duas internacionais, além de alguns ativistas e pesquisadores.40
O GTPI atua principalmente nas seguintes frentes buscando minimizar o evidente impacto negativo do sistema de patentes no Brasil:
1) Identificação de alternativas que permitam ampliar o acesso a medicamentos;
2) Fortalecimento da cooperação Sul-Sul para a troca de experiências no tema e possível ação conjunta entre organizações da sociedade civil;
3) Formação e mobilização da opinião pública quanto ao impacto social dos acordos comerciais de propriedade intelectual;
4) Acompanhamento de fóruns internacionais que discutam o tema da propriedade intelectual e acesso a medicamentos.
A cooperação Sul-Sul é fundamental para a atuação no tema de propriedade intelectual e acesso. De fato, a alteração do marco legal na seara da propriedade intelectual teve um impacto mais profundo nos países do sul. Em verdade, havia e ainda há uma assimetria entre os países desenvolvidos e em desenvolvimento no que tange ao desenvolvimento tecnológico, à capacidade de lidar com o intrincado ferramental técnico das recém incluídas patentes farmacêuticas em seus escritórios nacionais de patentes, e principalmente à capacidade aquisitiva de suas populações para acessar os medicamentos patenteados. Nesse sentido a cooperação entre países do sul, tanto no âmbito da sociedade civil organizada, quanto nos âmbitos dos governos é fator essencial para o sucesso do trabalho da sociedade civil brasileira.
Esta cooperação visa ao estabelecimento de novas parcerias com o propósito de ampliar a colaboração fática e troca de informações, metodologias e tecnologias de trabalho, além de promover a participação efetiva da sociedade civil nacional e internacional no estabelecimento dos acordos entre os governos dos seus países. As trocas de experiência contribuem para o alcance de resultados efetivos em cada país, respeitadas as especificidades de cada um. Importante exemplo desta troca entre organizações do Sul são os subsídios aos exames de patente, que serão abordados mais adiante. Como o mesmo pedido de patente é feito em diferentes países, os argumentos utilizados para questionar a concessão de uma patente específica pode ser também aproveitado por organizações de outros países.
Outra importante estratégia de atuação do GTPI é a formação de indivíduos, organizações e movimentos sociais que atuam em áreas impactadas pelo sistema de propriedade intelectual. O tema da propriedade intelectual, notadamente o tema das patentes farmacêuticas é normalmente entendido como um tema para especialistas e de pouca absorção por parte dos grupos organizados. O GTPI vem desenvolvendo metodologias específicas para o trato do tema, através da redação de cartilhas (sobre a legislação internacional e nacional e também de fatos importantes, como a emissão da licença compulsória no Brasil41 ) e a organização de oficinas e exercícios temáticos para os mais diversos públicos, buscando demonstrar como a propriedade intelectual afeta suas vidas e os seus trabalhos.
Além disso, o GTPI tem buscado inserção na mídia nacional e internacional, no sentido de lutar por um espaço na formação da opinião pública sobre o tema. Entendemos que os conceitos e ideários sobre a ligação entre patentes e inovação encontram-se atualmente em disputa e a participação e visibilidade da sociedade civil é de extrema relevância.
Ademais, o GTPI também considera importante participar de iniciativas que, para além das discussões sobre os impactos causados pelo atual sistema de proteção à propriedade intelectual, busquem a proposição de novos modelos e alternativas. O debate sobre outras formas de estímulo à invenção vem crescendo entre os principais atores internacionais e acredita-se que a colaboração dos países do sul deve ser considerada de forma enfática, tendo em vista que são esses países as maiores vítimas do sistema em curso. Nesse sentido, considera-se extremamente relevante o monitoramento das discussões e negociações no âmbito do Grupo Intergovernamental de Trabalho sobre Saúde Pública, Inovação e Propriedade Intelectual (conhecido como IGWG) da Organização Mundial da Saúde.
No âmbito nacional, as ações de advocacy do GTPI tem tomado corpo e a inclusão do GT no rol dos atores influentes na matéria no país pode ser constatada através de ações concretas levadas à cabo nos últimos anos. Dentre estas se podem destacar quatro ações que foram realizadas pelo GTPI com o intuito de assegurar e ampliar o acesso a medicamentos no Brasil, principalmente para o tratamento do HIV/AIDS. São elas: (a) ação civil pública para emissão de licença compulsória, (b) subsídios ao exame de patentes no INPI e ação de nulidade de patente, (c) pareceres legislativos e (d) representação ao Procurador Geral da República sobre a constitucionalidade das patentes concedidas pela via pipeline. A seguir abordaremos brevemente estas ações e seus principais desdobramentos:
Os gastos com a compra do medicamento Kaletra® (associação dos princípios ativos Lopinavir e Ritonavir), produzido pelo Laboratório Abbott, representava em 2005 aproximadamente 30% de todo o gasto do Programa Nacional DST/AIDS com a compra de medicamentos. Este valor exorbitante levou o governo brasileiro a entrar em um processo de negociação com a Abbott visando à redução do preço do medicamento.
Depois de frustradas tentativas de negociação, o então Ministro da Saúde do Brasil declarou em junho de 2005 a fabricação do Kaletra® como sendo de interesse público. Esta declaração foi o primeiro passo para a concessão de uma licença compulsória por interesse público, já que possibilitaria a produção nacional do referido medicamento, com custo menor e transferência de tecnologia. À época, o Brasil pagava por comprimido do Kaletra® US$ 1,17. Havia uma expectativa de que se fosse emitida a licença compulsória, o produto poderia ser produzido por Farmanguinhos por US$ 0,41.42
No entanto, ao mesmo tempo em que declarou o interesse público do Kaletra®, o governo brasileiro concedeu um prazo adicional para que o Laboratório Abbott oferecesse uma diminuição do valor cobrado pelo medicamento, o que evitaria a adoção do licenciamento compulsório. Assim, em outubro de 2005, foi firmado um contrato entre o governo brasileiro e o Laboratório Abbott para o fornecimento do medicamento.43 O acordo, apesar de representar uma redução no preço cobrado pelo medicamento, previu cláusulas contrárias ao interesse público nacional, tais como: obrigatoriedade de não concessão de licença compulsória, não fornecimento de qualquer assistência de fabricação do medicamento e manutenção do preço estipulado até final de 2011, quando a patente do medicamento já estaria próxima a expirar.
Após a assinatura do acordo entre o governo e a Abbott, organizações da sociedade civil membros do GTPI ajuizaram, em conjunto com o Ministério Público Federal, uma ação civil pública inédita no Brasil contra o governo e contra a Abbott demandando a emissão de uma licença compulsória para o Lopinavir/Ritonavir. Uma decisão favorável permitiria a produção local de uma versão genérica do medicamento.44
No entanto, a medida liminar que foi solicitada no começo do processo foi negada sob os argumentos de que a emissão de uma licença compulsória geraria retaliações pelos países desenvolvidos, possível falta de medicamento e ausência de capacidade de produção nacional do medicamento. A medida liminar é uma decisão que analisa o objeto da ação, mas não representa uma decisão final no processo.
Visando combater os argumentos utilizados para não concessão da medida liminar, em 2006, o GTPI, apoiado pela organização internacional Médicos Sem Fronteiras (MSF), contratou especialistas nacionais e internacionais para avaliar a capacidade técnica de quatro laboratórios nacionais (dois públicos e dois privados) para a produção de medicamentos antiretrovirais. Ficou comprovada a capacidade de produção local dos laboratórios brasileiros para produzir antiretrovirais tanto de primeira quanto de segunda linha.45 Estes resultados foram também verificados em outros dois estudos concomitantes levados a cabo no Brasil pela Fundação Clinton e pelo Programa das Nações Unidas para o Desenvolvimento (PNUD). A produção nacional do medicamento supriria a demanda do medicamento, e até que o medicamento fosse produzido internamente, o mesmo poderia ser importado de outros países em que fosse comercializado pelo laboratório detentor da patente.
Estes argumentos foram utilizados na ação civil pública como forma de subsidiar a decisão final do juiz na ação, uma vez que a medida liminar que foi negada é um pedido prévio que não encerra o processo. A ação civil pública ainda está em fase de instrução e aguarda julgamento.
Também em 2006, organizações membros do GTPI experimentaram utilizar canais administrativos para tentar evitar a concessão de patentes indevidas para medicamentos essenciais pelo escritório de patentes nacional (INPI). Assim, foram apresentados dois subsídios ao exame de patentes: o primeiro refere-se ao pedido de uma segunda patente para a combinação lopinavir-ritonavir (Kaletra®) solicitada pela Abbott e o segundo é referente ao pedido de patente para o fumarato de tenofovir disoproxil (Viread®) solicitado pela Gilead.
Subsídio ao exame de patente é uma previsão contida na legislação brasileira de propriedade intelectual que permite a qualquer interessado a apresentação de documentos e informações para subsidiarem o exame do pedido de patente em análise no INPI (artigo 31, LPI).
A apresentação de subsídio ao exame perante o INPI teve por objetivo oferecer argumentos técnicos para que os pedidos de patente dos medicamentos anti-retrovirais não fossem concedidos. Esses medicamentos tiveram seus pedidos de patente questionados com base em diferentes argumentos. No caso do fumarato de tenofovir disoproxil, todas as substâncias descritas já se encontravam reveladas no estado da técnica antes da data de prioridade do pedido. O princípio ativo que atua no combate à AIDS é o tenofovir, conhecido desde 1989, e os demais compostos desenvolvidos não apresentam qualquer efeito técnico novo para um especialista no assunto, pois tratam de práticas usuais empregadas em síntese orgânica. Assim, este pedido de patente de invenção não apresenta qualquer atividade inventiva.46
No caso da composição lopinavir/ritonavir, a empresa fez um pedido de segunda patente (“patente de divisão”) para o produto. A primeira patente já foi concedida pelo mecanismo pipeline– dispositivo da lei brasileira considerado por muitos juristas inconstitucional e que permitiu a concessão de patentes sem avaliação dos requisitos de patenteabilidade previstos em lei. Ocorre que não há qualquer previsão legal para o requerimento de divisão de pedidos de patentespipeline. Assim, estes pedidos de patente não poderão ser concedidos pelo INPI por não atenderem os requisitos de patenteabilidade previstos na legislação brasileira.
Ainda no campo de atuação referente à concessão de patentes, em meados de 2007, organizações do GTPI ajuizaram uma ação de nulidade de patente em que questionavam a validade de uma patente concedida a um kit de diagnóstico. Além de não ser permitida a concessão de patentes para kit diagnóstico no Brasil, de acordo com permissão contida no TRIPS, a patente questionada foi concedida pelo mecanismo pipeline, já acima abordado.
Esta ação ainda está em sua primeira etapa no Judiciário e há dúvidas sobre a legitimidade de organizações da sociedade civil ingressarem com este tipo de ação. Caso a legitimidade seja admitida, o GTPI pretende ajuizar outras ações deste tipo questionando a legalidade de patentes concedidas indevidamente para insumos essenciais no Brasil.
Outra forma de atuação do GTPI consiste em acompanhar projetos de leis propostos no tema de propriedade intelectual. Com isso, pretende-se evitar que leis que são contrárias ao interesse público sejam aprovadas, evitando-se grandes prejuízos posteriores. Trata-se, assim, de uma estratégia de atuação preventiva.
Neste sentido, destacamos dois casos em que o GTPI atuou.
• inclusão de medicamentos anti-retrovirais no rol de matérias não patenteáveis;
• vinculação entre registro sanitário de um medicamento e expiração dos direitos de propriedade intelectual (linkage).
O primeiro caso refere-se ao Projeto de Lei 22/2003, o qual pretende incluir medicamentos ARV no rol de matérias não passíveis de proteção patentária no Brasil. Em 2005, organizações membros do GTPI enviaram aos deputados envolvidos na análise do projeto um parecer que apóia a aprovação do projeto de lei (PL). O PL está em perfeita consonância com os princípios basilares da Constituição da República Federativa do Brasil, que prima pela prevalência do direito à saúde e à vida em face dos direitos comerciais e de eventuais interesses econômicos das empresas farmacêuticas. Além disso, atende às regulamentações internacionais acerca do tema, uma vez que estas, mesmo reconhecendo o direito da propriedade industrial, estabelecem que os países em desenvolvimento, como o Brasil, não só podem como devemadotar medidas que protejam a saúde pública e assegurem o acesso a medicamentos para todos em casos extremos de epidemia, como a AIDS. O projeto de lei obteve parecer favorável e ainda aguarda votação na Câmara dos Deputados.
O segundo parecer47 foi elaborado contra a aprovação do Projeto de Lei 29/2006, que visa vincular a concessão do registro sanitário de um medicamento à expiração de sua respectiva patente. O parecer foi encaminhado a senadores e deputados ligados a questões de saúde. Na prática, o vínculo entre patentes e registro sanitário estabelece uma barreira adicional à entrada de versões genéricas no mercado, visto que atrela o início do trâmite de obtenção do registro sanitário ao momento posterior à expiração da patente. Ou seja, protela a promoção da concorrência de medicamentos, mesmo que estes estejam fora de proteção patentária, sendo absolutamente contrário à saúde pública. Caso este projeto de lei seja aprovado, a exceção Bolar será excluída da legislação brasileira. Já há um parecer pelo arquivamento do projeto de lei, mas este ainda aguarda análise de outras comissões do Senado Federal.
No final de 2007, o GTPI apresentou ao Procurador Geral da República uma representação48 que demonstra a inconstitucionalidade de dois artigos da legislação brasileira de propriedade intelectual, que criaram o mecanismo de concessão de patentes conhecido como pipeline. A representação pede ao Procurador Geral da República para que este ingresse com uma ação direta de inconstitucionalidade (ADIN) contra o mecanismo pipeline perante o Supremo Tribunal Federal, uma vez que organizações da sociedade civil não possuem legitimidade para ajuizar este tipo de ação.49
Uma ação direta de inconstitucionalidade (ADIN) é um instrumento judicial que permite o controle concentrado de constitucionalidade de uma lei ou ato normativo em âmbito federal, ou seja, por meio desta ação é possível questionar se determinada legislação – federal ou estadual – está ou não de acordo com a Constituição Federal brasileira. A ADIN é julgada diretamente pelo Supremo Tribunal Federal – tribunal máximo no Brasil – e a declaração de inconstitucionalidade resulta por retirar a norma questionada do ordenamento jurídico e impedir que esta produza quaisquer efeitos.
As patentes pipeline foram concedidas durante o período de vacância da lei de propriedade intelectual brasileira, alterada em 1996. Ferem a Constituição Federal por concederem proteção patentária a conhecimentos que já estavam em domínio público, violando direito adquirido da coletividade. Além disso, ferem também as razões pelas quais a Constituição determinou proteção à propriedade intelectual, uma vez que não atendem ao interesse econômico e tecnológico do país. Assim, não há nada que justifique a sua concessão. Um parecer elaborado a pedido dos autores da representação revela o prejuízo econômico causado pelas patentes pipeline, estimado na ordem de bilhões de dólares.
Este tipo de mecanismo de revalidação de patentes foi adotado em apenas alguns poucos países além do Brasil e, dentre estes, em alguns países como o Equador, já foi declarado incompatível com o sistema de proteção a propriedade intelectual adotado internacionalmente.50
A representação tem por objetivo a propositura de uma ADIN, ou seja, o principal objetivo é demonstrar que as patentes pipeline são contrárias à Constituição Federal brasileira. No entanto, acreditou-se ser de relevância ao caso demonstrar que as patentes pipeline não são parte do sistema internacional de proteção à propriedade intelectual e, em certos pontos, são incompatíveis com este sistema. Esta estratégia teve o intuito de evitar que as regras do sistema internacional de proteção à propriedade intelectual possam ser utilizadas como entrave ao questionamento dessas patentes perante o Poder Judiciário brasileiro, como já ocorreu no caso da não concessão da medida liminar na ação civil pública para a licença compulsória do Kaletra, como acima relatado.
Assim, demonstrou-se que o mecanismo pipeline não foi uma exigência de acordos adotados pelo Brasil em âmbito internacional e é até mesmo incompatível com o Acordo TRIPS, a Convenção da União de Paris – CUP e o Tratado de Cooperação em Patentes – PCT da Organização Mundial de Propriedade Intelectual.
Foram recebidas diversas cartas de organizações da sociedade civil internacional especialistas no tema que demonstram seu apoio à ação do GTPI, além de reforçarem os argumentos de incompatibilidade das patentes pipeline com o sistema internacional.51 Estas cartas de apoio recebidas também demonstram a importância da ação no cenário internacional, principalmente em relação ao papel de liderança que o Brasil exerce em âmbito internacional em questões relacionadas à propriedade intelectual e à saúde pública.
De fato, o Brasil, ao longo dos últimos anos, tem exercido um importante papel de liderança para que as regras de proteção à propriedade intelectual adotadas em âmbito internacional não ponham em risco os sistemas de saúde pública nos países em desenvolvimento. No entanto, em âmbito interno, a postura adotada tem sido sempre de prevalência dos direitos da propriedade intelectual sobre a saúde pública, em flagrante contradição com a postura adotada pelo país em foros internacionais. O questionamento judicial das patentes pipeline, absolutamente contrárias ao interesse público, é mais um passo no caminho de fazer prevalecer dentro do Brasil o discurso já adotado na arena internacional.
Por fim, ressaltamos que as patentes pipeline estão longe de ser um assunto do passado. Como já mencionado, centenas de pedidos de patente depositados pelo pipeline ainda aguardam decisão do INPI. Inúmeros outros casos, nos quais as patentes já foram concedidas e já estão perto do final do prazo de proteção, estão tramitando no Poder Judiciário brasileiro visando à extensão dos prazos.52
A representação foi protocolada no final de dezembro de 2007 e aguarda-se a realização de uma audiência com o Procurador Geral da República para tratar do caso.
São muitos os desafios enfrentados pela sociedade civil ao tentar manter as políticas de acesso universal a medicamentos acima das regras de propriedade intelectual. Estes desafios incluem tanto a procura por alternativas dentro do atual sistema de patentes, forçando a implementação das flexibilidades ao TRIPS, como também o monitoramento de discussões internacionais sobre o tema, especialmente sobre “inovação e acesso”, o que implica a discussão de novos modelos de proteção à propriedade industrial.
A complexidade do tema e o tempo necessário para acompanhar as discussões constituem importantes barreiras ao envolvimento da sociedade civil em questões envolvendo o sistema de proteção à propriedade intelectual. Neste sentido, a elaboração de materiais informativos com linguagem acessível e a demonstração do impacto deste sistema na vida cotidiana das pessoas são essenciais para que o tema possa ser captado pela sociedade. A realização de cursos de formação para ativistas e organizações da sociedade civil com interesse direto no tema também tem se mostrado essencial neste sentido.
As estratégias que vêm sendo propostas pela sociedade civil brasileira revelam os importantes desafios no presente e para o futuro nos países em desenvolvimento, podendo ser vistos sob três ângulos: (a) perspectiva de produto por produto; (b) o sistema nacional de patentes; e (c) a necessidade da reforma do sistema internacional de patentes. O primeiro está relacionado ao constante monitoramento de novos medicamentos que estão sendo adotados pelo consenso terapêutico, bem como das barreiras para o acesso. Acredita-se que é muito importante o fortalecimento da cooperação entre países em desenvolvimento, uma vez que eles provavelmente enfrentarão os mesmos problemas para os mesmos medicamentos. O segundo está relacionado ao sistema nacional como um todo e ao seu impacto nas políticas de saúde, como os casos já mencionados. Esta perspectiva mais ampla representa desafios estruturais para a implementação constante das políticas de saúde. Por fim, o mais desafiante de todos os aspectos é refletir sobre uma fonte alternativa para estimular o desenvolvimento de novos medicamentos sem passar necessariamente pela apropriação intelectual, notadamente o sistema de patentes, que vem demonstrando seu caráter impeditivo ao acesso das populações mais vulneráveis.
Acredita-se, portanto, na importância do fortalecimento da sociedade civil e do aprofundamento de suas redes para que possa ser aprimorada a troca de experiências, o apoio aos problemas nacionais, e a busca por alternativas conjuntas contra os impactos negativos causados pelas patentes no acesso à saúde.
Por fim, acreditamos que a via judicial pode e deve ser utilizada como um canal em potencial para a defesa de direitos coletivos principalmente porque: (a) é uma forma de achar alternativas dentro do atual sistema de patentes em vigor no Brasil; (b) é uma forma de aumentar a atenção pública sobre os impactos negativos dos direitos de propriedade intelectual no acesso à saúde; (c) é uma forma de estimular a participação e envolver o Poder Judiciário na adoção de medidas que possam pressionar o Poder Executivo a implementar flexibilidades para a proteção da saúde pública.
Em relação à implementação das flexibilidades existentes, principalmente a licença compulsória, o recente caso do Efavirenz permitiu um maior avanço da percepção de como a sociedade em geral lida com o tema. Ao mesmo tempo em que houve muita pressão na grande mídia contra a licença compulsória emitida pelo governo brasileiro, muitos grupos puderam apoiar o interesse público e a importância da medida. Muitos grupos estiveram pressionando para a implementação das flexibilidades para a proteção da saúde pública como parte da agenda de movimentos HIV/AIDS e de saúde. Ainda, houve grande apoio internacional à adoção da licença compulsória.53
Neste caso, também houve a demonstração de que o governo brasileiro está comprometido com o acesso universal a tratamento e à saúde. Apesar disso, alguns fatores foram essenciais para que o governo tomasse esta medida: o importante precedente aberto pela Tailândia ao emitir uma licença compulsória e a existência de uma oferta no mercado farmacêutico internacional para o fornecimento do medicamento licenciado. Essa oferta reduziu a possibilidade de falta do medicamento.
No entanto, esta não é uma batalha encerrada e existem muitas outras barreiras a serem superadas. Já é sabido que os custos de novos anti-retrovirais estão aumentando e demandam a maior parte do orçamento do Ministério da Saúde para a compra destes medicamentos. Cada vez mais pacientes estão fazendo uso dos medicamentos de segunda linha, medicamentos estes patenteados no Brasil. Os medicamentos ainda mais novos também estão patenteados em outros países em desenvolvimento produtores de genéricos, como a Índia. Assim, em caso de emissão de uma licença compulsória, não haverá nenhuma outra oferta no mercado para o fornecimento do medicamento, sendo a única alternativa a sua produção local.
São muitos os desdobramentos do tema e muitas as esferas que devem ser monitoradas para que possa haver um bom acompanhamento do que ocorre não apenas em âmbito nacional, mas também em âmbito internacional, uma vez que as decisões tomadas nesta esfera impactam diretamente o sistema nacional. Além disso, também é importante acompanhar o que ocorre nos sistemas nacionais de outros países em desenvolvimento, uma vez que é muito provável que o mesmo ocorra também dentro de seu país.
Neste sentido, é fundamental que haja uma boa troca de informações e experiências entre grupos que atuam nesta área, a fim de que possam ser construídas estratégias conjuntas de enfrentamento a problemas semelhantes e que experiências de sucesso possam ser adaptadas aos diferentes contextos. Foi este o objetivo primordial do presente artigo.
1. BRASIL. Programa Nacional de DST/AIDS, AIDS no Brasil. Disponível em: <www.aids.gov.br/data/Pages/LUMIS13F4BF21PTBRIE.htm>. Acessado em: 25 de out. de 2007.
2. BRASIL. Programa Nacional de DST/AIDS, Resposta + Brasília, 2005. Disponível em: <http://www.aids.gov.br/data/documents/storedDocuments/%7BB8EF5DAF-23AE-4891-AD36-1903553A3174%7D/%7BEE03B6A9-6598-423D-BCF9-D41DBFC04408%7D/resp-posit01web.pdf>. Acessado em: 21 de jan. de 2008.
3. Organização Mundial da Saúde (OMS). Progress on global access to HIV antiretroviral therapy: a report on ‘3 by 5’ and beyond. Genebra, 2006. Disponível em: <http://www.who.int/hiv/fullreport_en_highres.pdf>. Acessado em: 30 de out. de 2006.
4. Brasil. Programa Nacional de DST/AIDS, Sistema de Monitoramento de Indicadores, 2006.. Disponível em: <http://sistemas.aids.gov.br/monitoraids2/abrir.asp?valor=234>. Acessado em: 22 de jan. de 2008.
5. Consulta realizada por correio eletrônico com o Programa Nacional de DST/AIDS em 15 de ago. de 2007.
6. BRASIL. Coordenação-Geral de Ações de Suporte às Ações de Assistência Farmacêutica – CGSAF/DAF/SCTIE, apud GRECO, Dirceu B. Desafios da epidemia de AIDS após 10 anos de terapia anti-retroviral. 2007. Disponível em: <http://www.aids.gov.br/data/documents/storedDocuments/%7BA07528E1-7FB7-4CC7-97AD-B7CB17C9CA85%7D/%7B73A9984F-4F25-4E3D-AA91-10E82E30A86E%7D/ADESAO-01GrecoBrasilia-19-06-07%20%20%2003.pdf>. Acessado em: 22 de jan. de 2008.
7. Neste sentido, ver: BRASIL. Programa Nacional de DST/AIDS. A sustentabilidade do acesso universal a anti-retrovirais no Brasil. Brasília, 2005. Disponível em: <http://www.aids.gov.br/data/documents/storedDocuments/%7BB8EF5DAF-23AE-4891-AD36-1903553A3174%7D/%7B0938AD30-E212-4E08-AE96-7C96622C85A3%7D/Cons._nacional_sustentabilidade.doc>. Acessado em: 21 de jan. de 2008.
8. K inzo, M. A.G. A democratização brasileira – um balanço do processo político desde a transição.São Paulo em Perspectiva. São Paulo, v.15, n. 4, p. 3-12, out/dez., 2001.
9. ESCOREL, S. Reviravolta na Saúde. Origem e articulação do Movimento Sanitário. Rio de Janeiro: Fiocruz, 208 p., 1999.
10. BRASIL. Programa Nacional DST/AIDS. História do Programa Nacional – AIDS vinte anos – Esboço histórico para entender o Programa Brasileiro, 2006. Disponível em: <http://www.aids.gov.br>. Acessado em: 27 de fev. de 2007.
11. Idem.
12. SCHEFFER, M.; SALAZAR, A. e GROU, K. O remédio via Justiça – Um estudo sobre o acesso a novos medicamentos e exames em HIV/Aids no Brasil por meio de ações judiciais. Brasília: Ministério da Saúde, 136 p., 2005.
13 OLIVEIRA M.A. e ESHER, A. Acesso universal ao tratamento para as pessoas vivendo com HIV/Aids no Brasil. In: BERMUDEZ, J.A.Z.; OLIVEIRA, M.A. e ESHER, A. (orgs.). Acceso a medicamentos: derecho fundamental, papel del Estado. Rio de Janeiro: ENSP/Fiocruz, 2004, p. 233-250.
14. Associação Brasileira Interdisciplinar de Aids – ABIA. Patentes: por que o Brasil paga mais por medicamentos importantes para a saúde pública?, 2006. Disponível em:
15. Organização Mundial do Comércio (OMC). Glossário e Fact sheet: TRIPS and pharmaceutical patents – obligations and exceptions. Disponíveis em:
16. CHAVES, G.C. e OLIVEIRA, M.A. A proposal for measuring the degree of public health–sensitivity of patent legislation in the context of the WTO TRIPS Agreement. Bulletin of the World Health Organization, v. 85, n. 1, 2007, p. 49-56.
17. CHAVES, G.C. Patentes farmacêuticas: por que dificultam o acesso a medicamentos?.Rio de Janeiro: ABIA, 2006. Disponível em: <http://www.abiaids.org.br/cedoc/publicacoes>. Acessado em: 22 de jan. de 2008.
18. Ibid.
19. LIMA, L. C. W. Coordenador de propriedade intelectual da ANVISA. Disponível em: <http://comvisa.anvisa.gov.br/tiki-read_article.php?articleId=80&PHPSESSID= e40a0286138454e3702a6bec26c8ae07>. Acessado em: 22 de jan. de 2008.
20. Tailândia. Ministry of Public Health and the National Health Security Office. Facts and evidences on the ten burning issues related to the government use of patents on three patented essential drugs in Thailand, 2007. Disponível em: <http://www.moph.go.th/hot/White%20Paper%20CL-EN.pdf>. Acessado em: 3 de maio de 2007.
21. KIJTIWATCHAKUL, K. The right to health. Thailand: Medecins Sans Frontiéres-Belgium (MSF-B), Pharmacy network for Health Promotion (PNHP), Thai health Promotion Foundation and Third World Network, 2007.
22. FORD, N.; WILSON, D.; CHAVES, G.C.; LOTROWSKA, M. e KIJTIWATCHAKUL, K. Sustaining access to antiretroviral therapy in the less-developed world: lessons from Brazil and Thailand. AIDS. London, v. 21, supl 4: S21-S29, julho 2007.
23. Neste sentido, ver estudo produzido por Knowledge Ecology International (KEI). Recent examples of the use of compulsory licenses on patents. Disponível em: <http://www.keionline.org/misc-docs/recent_cls.pdf>. Acessado em: 22 de jan. de 2008.
24. BERMUDEZ, J.A. Z. ; OLIVEIRA, M.A. e CHAVES, G.C. O Acordo TRIPS da OMC e os desafios para a saúde pública. In: BERMUDEZ, J.A.Z.; OLIVEIRA, M.A. e ESHER, A. (orgs.), op.cit.; p. 69-90.
25. GRANJEIRO, A.; TEIXEIRA, L.; BASTOS, F.I. e TEIXEIRA, P. Sustainability of Brazilian policy for access to antiretroviral drugs. Revista de Saúde Pública, São Paulo, v. 40 (supl.), 2006. Disponível em: <http://www.scielo.br/pdf/rsp/v40s0/en_09.pdf>. Acessado em: 22 de jan. de 2008.
26. Grupo de Trabalho de Propriedade Intelectual (GTPI).Acordo do governo brasileiro com a Abbot frustra expectativas dos brasileiros, 13 de jul. de 2005. Disponível em: <http://www.rebrip.org.br/_rebrip/pagina.php?id=659>. Acessado em: 10 de jan. de 2008.
27. CHAVES, G.C. Perguntas e respostas sobre o licenciamento compulsório do medicamento Efavirez no Brasil. Rio de Janeiro: ABIA, 2007. Disponível em: <http://www.abiaids.org.br/cedoc/publicacoes/artigos.aspx?lang=pt&mid=6&smid=2&siid=7&fg=Materias%20Informativos>. Acessado em: 21 de jan. de 2008.
28. BRASIL. Chega ao Brasil 1º lote de efavirenz genérico usado no tratamento da AIDS. Brasília, Radiobrás, 02 de julho de 2007. Disponível em <http://www.agenciabrasil.gov.br/noticias/2007/07/02/materia.2007-07-02.7585739203/view>. Acessado em 20 de março de 2008. O valor pago por comprimido de uso adulto (600mg) foi de R$ 1. Cada adulto faz uso de 1 comprimido por dia, totalizando um custo de R$ 365 paciente/ano ou US$ 190 paciente/ano (considerando a taxa de conversão oficial de R$1.91 para 1 USD, vigente no dia do recebimento do lote).
29. BRASIL. Discurso do Presidente da República, Luiz Inácio Lula da Silva, na cerimônia de assinatura de ato de licenciamento compulsório do medicamento Efavirenz. Palácio do Planalto, Brasília, 4 de maio de 2007. Disponível em: <http://www.imprensa.planalto.gov.br/download/discursos/pr128-2.doc>. Acessado em: 22 de jan. de 2008.
30. Estado da técnica ou estado da arte é toda a informação tecnológica tornada acessível ao público no Brasil ou no exterior, por descrição escrita ou oral, por uso ou qualquer outro meio, antes da data do depósito da patente ou do modelo de utilidade (art. 11, § 1º da LPI).
31. BARBOSA, Denis B. Pipeline: uma inconstitucionalidade patente. Disponível em: <http://denisbarbosa.addr.com/27.rtf >. Acessado em: 3 de dez. de 2007.
32. De acordo com o artigo 4 da Convenção da União de Paris – CUP, aquele que tiver apresentado um pedido de patente de invenção em um determinado país terá o prazo de 12 meses para apresentar o mesmo pedido em outros países. Este prazo é conhecido como “período de prioridade”.
33. Idem.
34. Conforme consulta realizada no Banco de Patentes do Instituto Nacional de Propriedade Industrial em out. de 2007:
35. BERMUDEZ, J. A. Z.; EPSZTEJN, R.; OLIVEIRA, M.A. e HASENCLEVER, L. O acordo TRIPS da OMC e a proteção patentária no Brasil: mudanças recentes e implicações para a produção local e acesso da população aos medicamentos. Rio de Janeiro: Ensp-Fiocruz/OMS, 2000, p. 131.
36. CORIAT, B.; ORSI, F. e d’ALMEIDA, C. TRIPS and the international public health controversies: issues and challenges. Industrial and Corporate Change Advance Access, nov. 2006, p. 1-30.
37. BRASil. Instituto Nacional de Propriedade Intelectual (INPI). Disponível em: <http://www.inpi.gov.br/menu-esquerdo/patente/pasta_manual/DiretrizesQuimica.pdf/view?searchterm=diretrizes>. Acessado em: 22 de jan. de 2008.
38. DRAHOS, P. Bilateralism in intellectual property. Report commissioned by Oxfam GB as part of its Cut the Cost of Medicines Campaign. OXFAM, 2001. Disponível em: <http://www.oxfam.org.uk/what_we_do/issues/trade/downloads/biltateralism_ip.rtf>. Acessado em: 25 de jan. de 2008.
39. Para mais informações ver
40. Nacionais: ABIA, GIV, GAPA-SP, GAPA-RS, GESTOS, GRAB, Pela Vidda-SP, Idec, Conectas Direitos Humanos, RNP+ Maranhão, Federação Nacional dos Farmacêuticos. Internacionais: Oxfam, Médicos Sem Fronteiras.
41. ABIA, Patentes farmacêuticas: por que dificultam o acesso a medicamentos?, 2006. Disponível em: <http://www.abiaids.org.br/_img/media/cartilha_patentes.pdf>. Acessado em: 21 de jan. de 2008. Idem, Perguntas e respostas sobre o licenciamento compulsório do medicamento Efavirenz no Brasil, 2007. Disponível em: <http://www.abiaids.org.br/_img/media/EFAVIRENZ.pdf>. Acessado em: 21 de jan. de 2008. Idem, Propriedade intelectual: interfaces e desafios, 2007. Disponível em: <http://www.abiaids.org.br/_img/media/Anais_Rebrip_web.pdf>. Acessado em: 21 de jan. de 2008.
42. Agência Nacional da Aids.Técnicos da Saúde, Indústria e Comércio analisaram proposta da Abbott referente ao Kaletra, 19 de ago. de 2005. Disponível em: <http://sistemas.aids.gov.br/imprensa/Noticias.asp?NOTCod=66822>. Acessado em: 10 de jan. de 2008.
43. BRASIL. Ministério da Saúde, Acordo entre o Ministério da Saúde e o Laboratório Abbott.Disponível em: <http://www.aids.gov.br/data/documents/storedDocuments/%7BB8EF5DAF-23AE-4891-AD36-1903553A3174%7D/%7B132F255F-85A2-4939-8626-0BB7EE507C72%7D/AIDS.BR_.pdf>. Acessado em: 21 de jan. de 2008.
44. REIS, R. Patentes farmacêuticas, acesso e produção de ARVs. Boletim ABIA, Rio de Janeiro, ago-out. 2006.
45. FORTUNAK, J. M. e ANTUNES, O.A.C. A produção de ARV no Brasil – uma avaliação. Rio de Janeiro: ABIA/MSF, 2006. Disponível em: <http://www.abiaids.org.br/media/ARV.pdf>. Acessado em: 22 de jan. de 2008.
46. ABIA. Patentes: por que o Brasil paga mais por medicamentos importantes para a saúde pública?.2ª edição revisada, 2006. Disponível em: <http://www.abiaids.org.br/_img/media/patentes_GTPI.pdf>. Acessado em: 21 de jan. de 2008.
47. REBRIP. Parecer do Grupo de Trabalho sobre Propriedade Intelectual – Rebrip, Projeto de Lei 29 de 2006, proposto pelo ex-Senador Ney Suassuna (PMDB/PB).Parecer disponível em: <http://www.deolhonaspatentes.org.br/media/file/Proj_Leis/PL29_manifestacao_gtpi_rebrip.pdf>. Acessado em: 21 de jan. de 2008.
48. Representação disponível na íntegra na página eletrônica da Conectas Direitos Humanos: CONECTAS DIREITOS HUMANOS. Organizações contestam a constitucionalidade da Lei de Propriedade intelectual, 29 de nov. de 2007. Disponível em: <http://www.conectas.org/noticia.php?not_id=192>. Acessado em 22 de jan. de 2008.
49. Os legitimados para a propositura da ação direta de inconstitucionalidade estão estipulados no artigo 103 da Constituição Federal. São eles: o Presidente da República; a Mesa do Senado Federal; a Mesa da Câmara dos Deputados; a Mesa da Assembléia Legislativa ou da Câmara Legislativa do Distrito Federal; o Governador de Estado ou do Distrito Federal; o Procurador-Geral da República; o Conselho Federal da Ordem dos Advogados do Brasil; partido político com representação no Congresso Nacional; confederação sindical ou entidade de classe de âmbito nacional.
50. EQUADOR. Tribunal de Justicia de la Comunidad Andina. Proceso 1/AI/96, 30 de out. de 1996. Disponível em: <http://intranet.comunidadandina.org/Documentos/Procesos/1-AI-96.doc>. Acessado em: 15 de dez. de 2007.
51. Até a redação da versão final deste artigo em janeiro de 2008, os grupos e pesquisadores que enviaram cartas de apoio foram: 1 – Fundación IFARMA – Colômbia; Oxfam International; Thai network of people living with HIV/AIDS; (TNP+); AIDS ACCESS Foundation; Thai Foundation for consumers; Thai Rural Doctors society; Thai Chronic renal failure network; Thai Alternative Agriculture network; Thai Parents network; Thai Rural Pharmacist society; Thai NGOs Coalition on AIDS; FTA Watch; Drug Study Group; Prof. Kevin Outterson (Boston University School of Law); Prof. Brook K. Baker (Northeastern University School of Law); Knowledge Ecology International (KEI); Third World Network; Lawyers Collective HIV/AIDS Unit; Indian Network for People Living with HIV/AIDS; Delhi Network of Positive People; Alternative Law Forum; Cancer Patients Aid Association e ActionAID India.
52. Conforme consulta processual realizada nos Tribunais Regionais Federais em nov. de 2007.
53. Abaixo assinado de apoio à Licença Compulsória do Medicamento Efavirenz no Brasil. Disponível em: <http://www.agenciaaids.com.br/arquivos/lista_abia.doc>. Acessado em: 21 de jan. de 2008.