reflexiones y estrategias de la sociedad civil
El presente artículo aborda el sistema de protección a la propiedad industrial vigente en Brasil y su relación con la política de acceso universal a medicamentos para el tratamiento del SIDA. También presenta las principales estrategias de actuación de un grupo de la sociedad civil brasileña – GTPI/REBRIP – en relación con los principales problemas y desafíos identificados.
La política de acceso universal al tratamiento antirretroviral en Brasil ha mostrado importantes resultados. Entre 1997 y 2004, hubo una reducción del 40% en la mortalidad y del 70% en la morbilidad; entre 1993 y 2003 se observó un aumento de cerca de cinco años en la edad mediana de los óbitos por SIDA, reflejando un aumento en la sobrevida de los pacientes.1 Además, hubo una reducción de las hospitalizaciones del 80% que generó una ahorro de gastos del orden de los U$S 2.300 millones.2
Estos datos demuestran que, en los últimos diez años, el acceso a tratamiento antirretroviral (ARV) adecuado transformó sustancialmente la vida de los pacientes y los métodos de control de la infección determinada por el VIH, aumentando la calidad de vida de las personas que viven con SIDA, aumentando la expectativa de vida, reduciendo la transmisibilidad del virus, y ocasionando un descenso significativo en los índices de mortalidad. Ahí radica la importancia de asegurar el acceso universal al tratamiento a todos aquellos que lo necesitan.
Según estimativas de la Organización Mundial de la Salud –OMS–, cerca de 6,5 millones de personas, en los países pobres y en desarrollo necesitan urgentemente tratamiento ARV. Sin embargo, debido principalmente a la protección patentaria de los medicamentos y a los elevados precios practicados por las empresas fabricantes, sólo 1,3 millones de personas pueden recibir el tratamiento. Cerca del 80% de los 3 millones de personas que mueren anualmente como consecuencia del SIDA no tuvieron acceso al tratamiento medicamentoso disponible.3
Brasil es uno de los pocos países del mundo que mantiene una política de acceso universal y gratuito para el tratamiento del SIDA. De acuerdo con datos del Programa Nacional de DST/AIDS, se estima que hay en Brasil 546 mil personas infectadas con el virus VIH. De estas, 180 mil usan medicamentos ARV para tratar la enfermedad.4 El presupuesto total del Ministerio de Salud para la compra de medicamentos antirretrovirales en 2007 fue de R$ 984.000.000,00.5 Se estima que más del 80% de este valor se usa para la adquisición de 11 medicamentos patentados y 20% para la compra de 7 medicamentos fabricados por laboratorios nacionales.6
Esta enorme proporción del presupuesto empleado para la compra de medicamentos patentados ha puesto en riesgo la sustentabilidad y la universalidad de este programa de atención a la salud.7
El acceso al tratamiento adecuado es condición esencial para que millares de personas que viven con SIDA en Brasil puedan tener una vida más digna. El gobierno brasileño tiene la obligación legal de proporcionar tratamiento a todos los que lo necesiten. El éxito del Programa Nacional se debió en un primer momento a la fabricación nacional de medicamentos que se usan en el tratamiento y que no gozan de protección patentaria en el país. La importación de una gama cada vez mayor de medicamentos ARV patentados o en vías de patentamiento en Brasil puede volver insostenible la política de acceso universal y gratuito al tratamiento del SIDA en el país.
La implementación de la política de tratamiento universal tuvo lugar en un contexto histórico favorable en virtud del proceso de redemocratización del país, intensificado a partir de 1985. Este proceso condujo a la refundación de la estructura constitucional a partir de la promulgación de la nueva Constitución de la República Federativa de Brasil de 1988.8
En el caso de la salud, el “Movimiento Sanitario” –originario de la década de 1970 y formado inicialmente por profesionales y estudiantes del campo de la salud– tuvo un papel fundamental en el reconocimiento constitucional de que “la salud es un derecho de todo ciudadano y deber del Estado” (artículo 196, Constitución Nacional),9 y proporcionó las bases fundamentales para la construcción de un sistema público de salud. A partir de entonces se presentó el desafío de desenvolver un sistema público de salud que obedeciera a principios fundamentales como la universalidad, la integralidad y la igualdad de acceso a los servicios de salud en todos los niveles de asistencia, sin prejuicios ni privilegios de ninguna especie. De esta forma fue creado el Sistema Único de Salud (SUS), reglamentado por medio de las Leyes 8.080/90 y 8.142/90. Se destaca que entre los campos de actuación del SUS está la asistencia terapéutica integral, incluyendo la farmacéutica, lo que implica la obligación de que el Estado provea medicamentos para todos aquellos que los necesiten.
En relación al combate de la epidemia de VIH/SIDA en el país, el primer programa oficial fue implantado en San Pablo, en 1983, caracterizado por la participación de la comunidad gay organizada con los técnicos de la Secretaría de Salud del Estado de San Pablo. En busca de una respuesta en el ámbito nacional, el Estado brasileño creó el Programa Nacional de SIDA en 1986.10
En 1985 y 1986 surgieron las primeras organizaciones no gubernamentales (ONG) volcadas al combate de la epidemia: Grupo de Apoyo a la Prevención del SIDA (GAPA) en San Pablo y Asociación Brasileña Interdisciplinar de SIDA (ABIA), en Río de Janeiro. A partir de entonces se desarrollaron varias campañas de prevención e iniciativas de lucha contra la discriminación y el prejuicio, así como el fomento a la solidaridad.11 La búsqueda de tratamiento también se convirtió en una demanda creciente.
El primer medicamento para el tratamiento del SIDA fue la zidovudina (AZT), inicialmente aprobado para esa indicación en 1987, por la agencia reguladora de medicamentos y alimentos estadounidense (FDA). El Ministerio de Salud brasileño hizo efectivo su uso en 1991. En paralelo al comienzo del uso en gran escala del AZT en Brasil, las empresas farmacéuticas transnacionales lanzaron nuevos medicamentos para el control del SIDA. La monoterapia con AZT pasó a ser considerada ineficiente marcando el comienzo de la recomendación de la terapia combinada (conocida como “cóctel”) a nivel internacional.12
Frente a las nuevas formas de tratamiento, muchos médicos comenzaron a prescribir esquemas todavía no incorporados en las recomendaciones oficiales del sistema de salud brasileño. El ritmo desigual entre el surgimiento de nuevos productos, la incorporación en el ámbito del sistema público de salud y la necesidad inmediata de nuevos esquemas para algunos individuos ya intolerantes a los existentes condujeron a la búsqueda de soluciones en la esfera judicial para viabilizar el acceso a los medicamentos demandados.
A partir de 1996 las primeras acciones judiciales de garantías individuales, que reivindicaban los medicamentos más nuevos, comenzaron a ser juzgadas y alcanzaron decisiones favorables a los pacientes. Los principales argumentos utilizados incluían las normas dispuestas en la Constitución Nacional, en la Ley Orgánica de Salud 8.080/90 y en las Constituciones de los estados, siempre resaltados los derechos a la salud y a la vida.13
También en 1996, en un clima de fuerte movilización social y demanda de la Coordinación Nacional de SIDA, fue aprobada la Ley 9.313 –también conocida como Ley Sarney–, que fortaleció el marco legal ya existente para la garantía del acceso a ARV. La aprobación de esta ley fue determinante para una mejor estructuración del Programa Nacional de SIDA en lo que se refiere a la compra de medicamentos.
Aunque no se pueda afirmar que las acciones judiciales de garantía a medicamentos hayan sido determinantes para la aprobación de la Ley 9.313/96, se puede por lo menos evaluar que el hecho de que las asesorías jurídicas de las ONG/SIDA estuvieran activas en la lucha por la efectivación de los compromisos legales de derecho a la salud constituyó parte del clima favorable a la aprobación de la ley. O sea, el ejercicio de un derecho por parte del ciudadano puede haber contribuido en la estructuración y mejor organización de las respuestas gubernamentales. El proceso continuo de construcción e implementación de la política de acceso a ARV en el país tuvo como importante componente impulsador la movilización de la sociedad civil también en la esfera judicial.
Otro factor de fundamental importancia para la implementación de la política universal fue la posibilidad de producir localmente –en laboratorios públicos y privados nacionales– los medicamentos ARV a precios inferiores a los ofrecidos por las empresas transnacionales. A principios de la década de 1990, la producción de esos productos comenzó a llevarse a cabo porque la ley de propiedad industrial entonces vigente (Ley 5.772/71) no incluía el reconocimiento de patentes para productos y procesos farmacéuticos.
Sin embargo, también en 1996, en el mismo año en que se aprobó la Ley Sarney, también fue aprobada en el país la nueva Ley de Propiedad Industrial (Ley 9.279/96), que modificaría ampliamente el escenario que se había construido hasta entonces, al viabilizar el acceso a medicamentos por medio de la producción local a precios accesibles. La obligatoriedad de conceder patentes para el sector farmacéutico –impuesta por acuerdos internacionales– cambiaría completamente este escenario dificultando mucho la política de acceso universal vigente en Brasil.
La nueva ley brasileña de propiedad industrial buscaba adecuarse a las reglas del derecho internacional establecidas en el ámbito de la Organización Mundial del Comercio –OMC–, creada en diciembre de 1994. Los Estados Miembros firmaron una serie de acuerdos multilaterales, entre ellos el Acuerdo sobre los Aspectos de los Derechos de Propiedad Intelectual Relacionados al Comercio (Acuerdo TRIPS o Acuerdo ADPIC), que estableció la obligatoriedad de reconocer la propiedad intelectual en todos los campos tecnológicos, incluyendo el sector farmacéutico.
De esta forma, los países tuvieron que modificar su legislación nacional para adecuarse al Acuerdo TRIPS, lo que representó para muchos el reconocimiento de campos tecnológicos no desarrollados internamente y un fortalecimiento de la reserva de mercado de las empresas transnacionales con sedes en los países desarrollados. En el caso de los medicamentos, componente esencial de la garantía del derecho a la salud, el Acuerdo TRIPS pasó a tratarlos como cualquier otra mercadería, lo que trajo perjuicios y barreras importantes para la implementación de políticas de salud, como se expondrá más adelante.
Como hemos visto, con la creación de la OMC en 1994 y con la firma del Acuerdo TRIPS, todos los países miembros de la Organización fueron obligados a modificar su legislación nacional y reconocer niveles mínimos de protección a la propiedad intelectual en todos los campos tecnológicos, incluso el farmacéutico. Sin embargo, el Acuerdo TRIPS concedió un plazo para que los países en desarrollo y países de menor desarrollo relativo que no reconocían patentes para algunos campos tecnológicos –como productos y procesos farmacéuticos– pasaran a hacerlo. Los países en desarrollo tendrían hasta 2005 para incorporar los niveles mínimos de protección en su legislación interna y los países menos avanzados tendrían hasta 2016, conforme a lo previsto en la Declaración de Doha sobre el Acuerdo TRIPS y Salud Pública, firmada en 2001.
El sistema de protección patentaria instituido por el Acuerdo TRIPS tiene por objetivo promover la innovación tecnológica y la transferencia y difusión de tecnología, de forma conducente al bienestar social y económico (artículo 7) y permite que los Miembros puedan adoptar las medidas necesarias para proteger la salud pública y para promover el interés público en sectores de importancia vital para su desarrollo económico y tecnológico (artículo 8).
Así, el Acuerdo TRIPS permite que los países miembros incluyan en su legislación algunas flexibilidades o salvaguardas que puedan garantizar protección para la salud pública. Las principales flexibilidades previstas en el Acuerdo TRIPS son: licencias obligatorias (artículo 31), importaciones paralelas (artículo 6), uso experimental (artículo 30), excepción Bolar (artículo 30) y actuación del sector de la salud en los procesos de pedidos de patentes farmacéuticas (implícita en el artículo 8), que serán mejor analizadas en este artículo.
Sin embargo, Brasil no aprovechó el período de transición de 10 años que fue dado por la OMC para reconocer patentes en el área de medicamentos. Este período fue ofrecido a los países en desarrollo que no reconocían patentes en esta área. Una de las principales ventajas de ese período sería permitir el fortalecimiento de los laboratorios nacionales para enfrentar la competencia con las empresas transnacionales de medicamentos, intensivas en Investigación y Desarrollo (P&D). Brasil utilizó el período de transición por menos de dos años, habiendo modificado su ley en 1996, con aplicación a partir de mayo de 1997.14 Además, la legislación brasileña dejó de adoptar algunas de las flexibilidades permitidas por el Acuerdo TRIPS y, en algunos aspectos, fue más allá de lo requerido por el Acuerdo.
Desde entonces surgieron distintos desafíos para mantener la política de acceso universal a medicamentos. El mayor de estos fue el aumento del costo del tratamiento debido al uso de nuevos medicamentos sujetos a protección patentaria y no producidos nacionalmente. (Esos nuevos medicamentos fueron siendo recomendados por el consenso terapéutico para reemplazar o complementar protocolos de tratamiento anteriores). Además, hubo también un aumento del número de pacientes en tratamiento.
La ley de patentes brasileña (LPI) incluyó algunas de las flexibilidades del Acuerdo TRIPS que son de interés para la salud pública (Cuadro 1). Las flexibilidades son dispositivos que buscan mitigar los efectos perversos de los derechos conferidos al titular de la patente buscando restablecer el equilibrio entre derechos de propiedad intelectual y derecho de acceso al conocimiento.
En el caso de la salud, las flexibilidades apuntan a dos objetivos, uno más inmediato y otro de mediano y largo plazo. La licencia obligatoria, las importaciones paralelas y la excepción Bolar son flexibilidades cuyo objetivo es inmediato, es decir, la obtención de medicamentos a precios más razonables, sea por medio de la entrada de versiones genéricas de medicamentos, sea por medio de la entrada de versiones genéricas de medicamientos, o por medio de la importación de productos que estén siendo comercializados internacionalmente a precios inferiores a los practicados en el país.
La licencia obligatoria fue incorporada por la legislación brasileña y puede ser concedida en base a distintos fundamentos. El artículo 68 de la legislación brasileña de patentes prevé que el titular quedará sujeto a tener la patente licenciada obligatoriamente si ejerce los derechos de ella derivados de forma abusiva o por medio de ella practique abuso de poder económico. El mismo dispositivo establece también que una licencia obligatoria podrá también ser concedida en caso de no explotación del objeto de la patente en territorio brasileño o cuando la comercialización del producto no satisfaga las necesidades del mercado. Podrá haber licenciamiento obligatorio también en casos de patentes dependientes, en los términos previstos en el artículo 70 de la LPI. Por último, el artículo 71 prevé que podrá ser concedida una licencia obligatoria en casos de emergencia nacional o interés público declarados en acto del Poder Ejecutivo Nacional.
La excepción Bolar, a su vez, fue incorporada por una enmienda a la ley de propiedad industrial, por medio de la Ley nº 10.196/2001, que incluyó el inciso VII en el artículo 43. El uso de esta flexibilidad tiene una doble ventaja para el país: además de favorecer la rápida entrada del medicamento genérico en el mercado, posibilita el aprendizaje por el uso de la información sobre la invención.
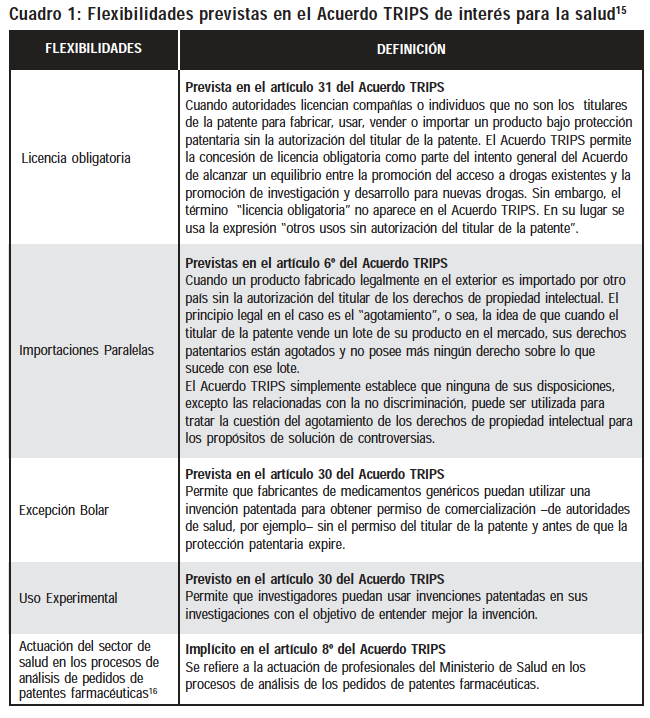
Las importaciones paralelas fueron también incorporadas, pero de forma muy limitada, ya que su utilización está condicionada a las situaciones de concesión de licencia obligatoria por abuso de poder económico (art. 68, §§ 3º y 4º, LPI). Hay un proyecto de ley (PL 139/99) tramitando en el Congreso Nacional para incorporar esta flexibilidad de forma plena. Para las políticas de acceso a medicamentos esta flexibilidad es extremadamente importante pues las empresas farmacéuticas multinacionales suelen establecer precios diferenciados para un mismo medicamento en los diferentes países. Así, la existencia de las importaciones paralelas en las legislaciones nacionales permite que un país importe un medicamento desde donde esté siendo comercializado a menor precio.17
El uso experimental y la actuación del sector salud en los procesos de pedidos de patentes farmacéuticas son flexibilidades que apuntan al mediano y largo plazo, pues buscan estimular el desarrollo tecnológico nacional, por medio del aprovechamiento del conocimiento revelado por la patente e impedir que sean concedidos derechos de exclusividad a los pedidos que no cumplan los requisitos legales de patentabilidad.
El uso experimental es permitido en Brasil y está previsto en el artículo 43, II de la LPI. Representa una de las formas de promover un equilibrio entre los intereses del titular de la patente y los intereses nacionales, porque posibilita el uso de la información revelada por la patente con el objetivo de promover el desarrollo científico y tecnológico del país. Esta investigación científica puede ser realizada por cualquier laboratorio de investigación, sea este público o privado.18
La actuación del sector de salud en el proceso de concesión de patentes farmacéuticas fue incorporada por la Ley 10.196/2001, que incluyó el artículo 229c en la legislación brasileña de propiedad intelectual. Este dispositivo determinó que la concesión de patentes en esta área solamente podría ser concedida con la anuencia previa de la Agencia Nacional de Vigilancia Sanitaria (ANVISA), órgano responsable de la seguridad sanitaria y de la garantía de la calidad de los medicamentos en el país.
Debido a la importancia del tema y a la esencialidad de los productos farmacéuticos, los legisladores brasileños entendieron que una materia de tal importancia merecería el examen más cuidadoso y técnicamente competente posible con que el Estado brasileño pudiera contar. El papel de la ANVISA en la anuencia previa no es, de esta manera, el de simplemente interferir en el proceso de concesión de patentes. Se trata de una medida para proteger a los pacientes evitando que se conceda una patente inmerecida.19
La anuencia previa está en perfecta consonancia con el Acuerdo TRIPS, que en su artículo 8° admite que cada miembro, al formular sus leyes nacionales, puede adoptar medidas que sean necesarias para la protección de la salud y para la promoción del interés público en sectores de vital importancia para su desarrollo socioeconómico y tecnológico, como lo es el sector de asistencia farmacéutica. A pesar de que esas flexibilidades están incorporadas en la legislación brasileña y son compatibles con las reglas internacionales que rigen la materia, el uso de flexibilidades que persiguen el ingreso de medicamentos a precios accesibles a corto plazo, ha sido bastante limitada, no sólo en Brasil sino también en casi todos los países en desarrollo. Recientemente, algunos países en desarrollo hicieron uso de estas medidas, especialmente de la licencia obligatoria, como forma de aumentar el acceso a tratamiento, como fue el caso de Tailandia20,21 y también de Brasil en 2007.22
En realidad, las licencias obligatorias ya fueron utilizadas en distintas situaciones y en distintos países, incluyendo países desarrollados.23 Es importante notar que a pesar de estar públicamente contra la emisión de licencias obligatorias para el tratamiento de enfermedades como el SIDA, países desarrollados como Estados Unidos por ejemplo, ya hicieron uso de licencias obligatorias cuando éstas tenían por objetivo la garantía de sus intereses.
En Brasil, la amenaza de emisiones de licencias obligatorias fue el principal instrumento de presión utilizado durante los procesos de negociación de precios de los medicamentos ARV. El laboratorio farmacéutico oficial de la Fundación Oswaldo Cruz, llamado Instituto de Tecnología en Fármacos o solamente “Farmanguinhos”, fue capaz de respaldar al Ministerio de Salud con referencias de precios aceptables y capacidad para producir en caso de impasse y emisión de licencia obligatoria. Las empresas prefirieron reducir los precios a tener sus productos producidos por la industria nacional.24
Sin embargo, por el hecho de que el gobierno brasileño nunca hasta entonces había emitido efectivamente licencias obligatorias para la producción local de medicamentos, la estrategia de negociación de precios se volvió ineficiente y los precios posteriormente alcanzados resultaron insatisfactorios. En los años 2004 y 2005, por ejemplo, los precios de los medicamentos nelfinavir y efavirenz se mantuvieron mientras que el precio del lopinavir/ritonavir fue reducido en un 1%. Los descuentos obtenidos para los nuevos medicamentos, tenofovir y atazanavir, fueron de un 5,2% y 7,7%, respectivamente. Por esa razón, el gasto medio por paciente en el año 2005 alcanzó el valor de R$ 6.124,00, equiparándose al período de 1998.25 Esa elevación de los gastos puso en riesgo la sustentabilidad del Programa Nacional de DST/AIDS.
En 2005, durante otra negociación con la empresa Abbott para reducir el precio del lopinavir/ritonavir, usado en la época por 17.000 personas, el gobierno brasileño dio un paso más hacia la emisión de una licencia obligatoria al declarar, mediante un decreto oficial, que el medicamento era de interés público y que la empresa tendría que ofrecer un precio más bajo. Tras meses de negociación el Ministro de Salud hizo un acuerdo con Abbott aceptando el precio fijo de U$S 1.380 por paciente/año hasta 011, no importando el incremento de la demanda o la variación internacional de precios. Además, en el acuerdo también quedó prevista la garantía de que no sería emitida una licencia obligatoria para este medicamento. Este acuerdo fue considerado por muchos grupos de la sociedad civil como un pésimo acuerdo y claramente TRIPS-plus ya que se establecieron cláusulas más restrictivas que las adoptadas por el TRIPS.26
La no emisión de una licencia obligatoria en este caso condujo a organizaciones miembros del Grupo de Trabajo sobre Propiedad Intelectual de la Red Brasileña por la Integración de los Pueblos (GTPI/REBRIP) a promover una acción civil pública con el objetivo de compeler al gobierno nacional a emitir una licencia obligatoria para el Kaletra. Esta estrategia de actuación del GTPI/REBRIP será objeto de un análisis posterior en el presente artículo.
La adopción de la licencia obligatoria ha sido apoyada por la sociedad civil brasileña en los últimos años como una forma de superar las amenazas a la sustentabilidad del acceso universal al tratamiento impuestas por el alto costo de los medicamentos. Sin embargo, esta flexibilidad sólo fue utilizada por Brasil en 2007, para el efavirenz. El costo por paciente/año en Brasil era de U$S 580 desde 2003, mientras que en el mercado internacional era posible encontrar precios dos veces más bajos. Tras un largo ntento de negociación con Merck, la única oferta realizada por la empresa fue la de reducir los precios en un 2%, oferta ésta inaceptable. Por ejemplo, este precio era dos veces mayor que el precio ofrecido por Merck a Tailandia, después de haber emitido este país una licencia obligatoria para el medicamento.
El efavirenz fue declarado de interés público en abril y la licencia obligatoria fue emitida en mayo de 2007.27 Mientras la producción local está siendo preparada por dos laboratorios públicos (Farmanguinhos y Lafepe), la versión genérica del medicamento está siendo importada de la India desde julio de 2007 por un costo de R$ 365 paciente/año,28 un tercio del precio ofrecido por Merck.
El licenciamiento obligatorio reveló un compromiso gubernamental con la sustentabilidad del acceso al tratamiento del VIH/SIDA, en un escenario en que los medicamentos sujetos a la protección patentaria presentan precios exorbitantes e inaccesibles para la gran mayoría de los países en desarrollo. Además, la posibilidad esbozada por el gobierno de hacer uso de la licencia obligatoria para otros medicamentos29 es extremadamente positiva, pues busca asegurar la sustentabilidad no sólo del Programa Nacional DST/AIDS, sino también de todo el sistema público de salud.
A pesar de que Brasil adoptó casi todas las flexibilidades de interés para la salud pública previstas en el Acuerdo TRIPS, hay algunos problemas internos tanto en la legislación sobre patentes como en su implementación que pueden ser perjudiciales a la salud pública. Entre ellos se destacan los siguientes:
a) mecanismo pipeline;
b) directrices de examen de patentes adoptadas por el Instituto Nacional de Propiedad Industrial -INPI;
c) dificultades para implementar el papel del Ministerio de Salud en el proceso de análisis de patentes farmacéuticas (anuencia previa);
d) medidas TRIPS-plus en votación en el Congreso Nacional.
La legislación sobre propiedad intelectual en Brasil, hasta la modificación que tuvo lugar en 1996, prohibía la concesión de patentes para algunas áreas tecnológicas, entre ellas productos y procesos farmacéuticos y alimenticios. Esta prohibición fue excluida por la nueva Ley de Propiedad Industrial (Ley nº 9.279/96). Esta ley reconoció la protección patentaria para todas las áreas tecnológicas, producto de exigencias estipuladas en el Acuerdo TRIPS de la OMC. Este acuerdo establece para todos los Miembros de la OMC la obligatoriedad de protección patentaria a invenciones de todos los sectores tecnológicos.
Sin embargo, al modificar su legislación para satisfacer los requisitos previstos en el Acuerdo TRIPS, Brasil fue más allá de las obligaciones asumidas en el ámbito internacional e incluyó en la nueva legislación un mecanismo de revalidación de patentes depositadas y concedidas en el exterior, conocido como pipeline.
El mecanismo pipeline constituye una disposición temporaria por medio de la cual se aceptaron depósitos de patentes en campos tecnológicos no reconocidos hasta entonces, posibilitando la protección patentaria de productos farmacéuticos y alimenticios, entre otros. Los pedidos de patentes por el mecanismo pipeline estarían sujetos sólo a un análisis formal y seguirían los términos de la patente concedida en el exterior, sin ser sometidos a un análisis técnico de los requisitos de patentabilidad –novedad, actividad inventiva y aplicación industrial– por la oficina de patentes brasileña (INPI).
Todavía más grave, la protección patentaria por la vía pipeline representa la concesión de privilegios a invenciones que ya se encontraban en dominio público. Brasil adopta el principio de la novedad absoluta en materia de patentes, o sea, si la tecnología para la cual se pide protección ya entró en el estado de la técnica30 en cualquier lugar, en cualquier tiempo, no puede ser protegida.31 Las invenciones protegidas por el pipeline ya se encontraban en el estado de la técnica, porque ya habían sido publicadas en el exterior. Como los pedidos de patente fueron hechos en Brasil tras el término del período de prioridad,32 las invenciones se encontraban en dominio público y ya no podrían ser protegidas.
Así, la concesión de patentes pipeline viola frontalmente el principio de la inderogabilidad del dominio público, por el cual un conocimiento, tras haber entrado en dominio público, no puede de éste ser retirado. El ingreso en el dominio público hace que determinado bien se vuelva común a todos y la colectividad adquiere el derecho de mantenerlo disponible, impidiendo su apropiación individual.33
A pesar de que se suele confundir, el mecanismo pipeline no es igual ni equivalente al mail-boxexistente en otros países, como en la India, y previsto en el Acuerdo TRIPS. El mail-box establece que a partir del “momento cero” del Acuerdo TRIPS (1995) las oficinas de patentes nacionales podrían recibir pedidos de patentes en las áreas no privilegiables hasta entonces y mantenerlos depositados, sin embargo, esos pedidos sólo serían analizados cuando la ley de patentes nacional entrara en vigor. En el caso de las patentes pipeline fue posible la protección retroactiva para objetos depositados o ya patentados en otros países, dentro o fuera del período de anterioridad. De esta manera se permitió la concesión de patentes para conocimientos que ya tenían patentes conocidas en el exterior incluso antes del momento cero del Acuerdo TRIPS. Además, las patentes pipeline no pasan por ningún análisis técnico en la oficina de patentes brasileña.
Las patentes pipeline causaron un gran impacto en áreas sensibles para el interés social y para el desarrollo tecnológico y económico del país. De acuerdo con los datos divulgados por el INPI, dentro del plazo legal de un año a contar desde la publicación de la Ley nº 9.279/96, fueron depositados 1.182 pedidos pipeline,34 de los cuales más de la mitad ya fueron concedidos y los demás están en marcha.35
El efavirenz, medicamento recientemente licenciado obligatoriamente, está protegido por una patente obtenida a través del mecanismo pipeline. O sea, cuando ese medicamento fue depositado en Brasil ya no atendía al requisito de novedad (pues la información sobre la invención ya había sido publicada en el exterior cinco años antes).36 Este principio activo podría haber sido fabricado en Brasil, tal como fue en la India.
Otros medicamentos fundamentales para dar una respuesta adecuada a la epidemia de VIH/SIDA, como el lopinavir/ritonavir, abacavir, nelfinavir y amprenavir, también fueron protegidos por elpipeline, así como el medicamento para cáncer, imatinib o Glivec (nombre comercial).
Debido al gran impacto causado por las patentes pipeline en Brasil, el GTPI resolvió cuestionar judicialmente este mecanismo de concesión de patentes. Esta acción será analizada en el próximo apartado del presente artículo cuando se abordarán las principales estrategias de actuación del GTPI.
En Brasil, el INPI, autarquía nacional vinculada al Ministerio de Desarrollo, Industria y Comercio Exterior, tiene por finalidad ejecutar las normas que regulan la propiedad intelectual teniendo en vista su función social, económica, jurídica y técnica, de acuerdo con la legislación de propiedad intelectual y con la Constitución Nacional. De este modo, cabe al INPI analizar pedidos de concesión de patentes en distintas áreas del conocimiento, incluso medicamentos.
Para el análisis de pedidos de patentes de medicamentos, el INPI emitió las “Directrices para el examen de pedidos de patente en las áreas de biotecnología y farmacéutica depositados después del 31/12/1994”.37 Tal documento tiene la función de orientar a los examinadores en la interpretación de la Ley de patentes brasileña sobre lo que debe o no ser objeto de protección patentaria. Sin embargo, tales directrices son más amplias que las reglas contenidas en la legislación brasileña de propiedad intelectual y están en desacuerdo con los objetivos perseguidos por la Constitución Nacional al conferir protección a la propiedad intelectual (art. 5º, XXIX, CF/88), generando la concesión de innumerables patentes en desacuerdo con las reglas vigentes en el país.
Mencionamos algunos ejemplos que ilustran el problema: la LPI no permite la protección de meros descubrimientos (artículo 10) ni la protección de pedidos que no atiendan al requisito de novedad (artículo 11). Sin embargo, las directrices del INPI incluyen la posibilidad de proteger nuevos usos de productos ya conocidos, posibilitando prácticas conocidas como evergreening en detrimento de la protección de reales innovaciones farmacéuticas. Otro ejemplo claro de afronta a la ley es el permiso de patentamiento de secuencias de DNA, bajo la justificativa de que las mismas son meros compuestos químicos y no parte de seres vivos.
De acuerdo con la legislación brasileña sobre propiedad intelectual, es necesario que los pedidos de patentes farmacéuticas cuenten con la anuencia previa de ANVISA, considerando su importancia para la salud pública.
El principal problema para implementar esta flexibilidad consiste en el hecho de que el INPI no publica las decisiones de ANVISA que no concedieron la anuencia previa, impidiendo la finalización completa del proceso que no concederá la patente. Esto significa que el pedido de patente sigue pendiente y el potencial titular de la patente goza, de cualquier manera, de un monopolio “de hecho”.
Además de los problemas antes destacados, hay otro problema que debemos enfrentar cuando actuamos con el tema de propiedad intelectual en Brasil. Actualmente están en trámite en el Congreso Nacional varios proyectos de ley que, si se aprueban, representarían la adopción de medidas TRIPS-plus en la legislación brasileña.
Las medidas TRIPS-plus representan formas de protección a la propiedad intelectual más restrictivas que las adoptadas por el TRIPS.38 Generalmente estas medidas buscan privilegiar los intereses de los titulares de las patentes en detrimento del interés público. En general estas medidas son negociadas en acuerdos de comercio bilaterales, negociados entre países desarrollados y países en desarrollo. Brasil no posee ningún acuerdo bilateral en negociación que implique protección a la propiedad intelectual. Sin embargo, estas medidas están en votación en proyectos de ley en del Poder Legislativo brasileño y es necesario estar alerta para que estas medidas no sean aprobadas. Esta es una evidencia muy simple de cómo las medidas TRIPS-plus pueden ser implementadas en los países en desarrollo más allá de los acuerdos bilaterales o regionales de libre comercio.
Ejemplo de esto es el Proyecto de Ley 29/2006, que busca la inclusión de una medida TRIPS-plus al prever la vinculación entre la protección patentaria y el registro sanitario del medicamento. Si se aprueba significa que, en la práctica, la excepción Bolar prevista en la legislación brasileña será anulada. Este caso será mejor analizado más adelante, cuando abordemos las estrategias de actuación del GTPI.
En virtud de la importancia de mantener políticas públicas como la de acceso universal a tratamientos antirretrovirales y de los desafíos y obstáculos impuestos por las nuevas reglas de protección a la propiedad intelectual, grupos de la sociedad civil brasileña, con apoyo de organizaciones internacionales resolvieron aunar esfuerzos para enfrentar el tema, al mismo tiempo relevante y complejo. Así, fue creado en 2001 el Grupo de Trabajo sobre Propiedad Intelectual de la Red Brasileña por la Integración de los Pueblos (GTPI/REBRIP).
REBRIP es una articulación de ONG, movimientos sociales, entidades sindicales y asociaciones profesionales autónomas y pluralistas que actúan sobre los procesos de integración regional y comercio, comprometidas con la construcción de una sociedad democrática pautada por un desarrollo económico, social, cultural, ético y ambientalmente sostenible. Estas entidades buscan alternativas de integración opuestas a la lógica de la liberalización comercial y financiera predominante en los acuerdos económicos actualmente en curso.39
Debido a la creciente discusión sobre la propiedad intelectual en el ámbito internacional y el impacto causado por los acuerdos internacionales en el ámbito nacional se demostró necesaria la creación de un grupo destinado a la discusión de temas tocantes a la propiedad intelectual y su repercusión en el acceso al conocimiento por parte de la sociedad brasileña. En este contexto fue creado el GTPI, coordinado por la Asociación Brasileña Interdisciplinar de SIDA – ABIA desde su creación en 2001 (que fue reconducida a la coordinación en las dos últimas asambleas de la REBRIP). El GTPI está formado por varias organizaciones de la sociedad civil brasileña y dos organizaciones internacionales, además de algunos activistas e investigadores.40
El GTPI actúa principalmente en los siguientes frentes buscando minimizar el evidente impacto negativo del sistema de patentes en Brasil:
1) Identificación de alternativas que permitan ampliar el acceso a medicamentos;
2) Fortalecimiento de la cooperación Sur-Sur para el intercambio de experiencias en el tema y posible acción conjunta entre organizaciones de la sociedad civil;
3) Formación y movilización de la opinión pública en cuanto al impacto social de los acuerdos comerciales de propiedad intelectual;
4) Seguimiento de foros internacionales que discutan el tema de la propiedad intelectual y el acceso a medicamentos.
La cooperación Sur-Sur es fundamental para la actuación en el tema de propiedad intelectual y acceso. De hecho, la modificación del marco legal en el campo de la propiedad intelectual tuvo un impacto más profundo en los países del sur. En realidad, había y todavía hay una asimetría entre los países desarrollados y en desarrollo en lo que atañe al desenvolvimiento tecnológico, a la capacidad de enfrentar el intrincado instrumental técnico de las recién incluidas patentes farmacéuticas en sus oficinas nacionales de patentes, y principalmente a la capacidad adquisitiva de sus poblaciones para acceder a los medicamentos patentados. En este sentido la cooperación entre países del sur, tanto en el ámbito de la sociedad civil organizada como en los ámbitos de los gobiernos es un factor esencial para el éxito del trabajo de la sociedad civil brasileña.
Esta cooperación busca el establecer nuevas alianzas con el propósito de ampliar la colaboración fáctica e intercambio de informaciones, metodologías y tecnologías de trabajo, además de promover la participación efectiva de la sociedad civil nacional e internacional en el establecimiento de los acuerdos entre los gobiernos de sus países. Los intercambios de experiencias contribuyen para la consecución de resultados efectivos en cada país, respetadas las especificidades de cada uno. Un importante ejemplo de este intercambio entre organizaciones del sur son las observaciones a los exámenes de patente, que serán abordadas más adelante. Como el mismo pedido de patente se hace en distintos países, los argumentos utilizados para cuestionar la concesión de una patente específica los pueden también aprovechar organizaciones de otros países.
Otra importante estrategia de actuación del GTPI es la formación de individuos, organizaciones y movimientos sociales que actúan en áreas impactadas por el sistema de propiedad intelectual. El tema de la propiedad intelectual, especialmente el tema de las patentes farmacéuticas es normalmente entendido como un tema para especialistas y de poca absorción por parte de los grupos organizados. El GTPI viene desarrollando metodologías específicas para el tratamiento del tema a través de la redacción de cartillas (sobre la legislación internacional y nacional y también de hechos importantes, como la emisión de licencias obligatorias en Brasil)41 y la organización de talleres y ejercicios temáticos para los más diversos públicos, con vistas a demostrar cómo la propiedad intelectual afecta sus vidas y sus trabajos.
Además, el GTPI ha buscado aparecer en los medios nacionales e internacionales, en el sentido de luchar por un espacio en la formación de la opinión pública sobre el tema. Entendemos que los conceptos e idearios sobre la ligazón entre patentes e innovación se encuentran actualmente en disputa y la participación y visibilidad de la sociedad civil es de extrema relevancia.
Además, el GTPI también considera importante participar de iniciativas que, más allá de las discusiones sobre los impactos causados por el actual sistema de protección a la propiedad intelectual, busquen proponer nuevos modelos y alternativas. El debate sobre otras formas de estímulo a la invención viene creciendo entre los principales actores internacionales y se cree que la colaboración de los países del sur debe ser considerada de forma enfática, teniendo en cuenta que son esos países las mayores víctimas del sistema en curso. En este sentido, se considera extremadamente relevante el monitoreo de las discusiones y negociaciones en el ámbito del Grupo Intergubernamental de Trabajo sobre Salud Pública, Innovación y Propiedad Intelectual (conocido como IGWG) de la Organización Mundial de la Salud.
En el ámbito nacional, las acciones de advocacy del GTPI han ganado cuerpo y la inclusión del GT en el listado de los actores influyentes en la materia en el país puede constatarse a través de acciones concretas llevadas a cabo en los últimos años. Entre estas se pueden destacar cuatro acciones que fueron realizadas por el GTPI con el objetivo de asegurar y ampliar el acceso a medicamentos en Brasil, principalmente para el tratamiento del VIH/SIDA. Son ellas: (a) acción civil pública para la emisión de licencias obligatorias, (b) observaciones en el examen de patentes en el INPI y acción de nulidad de patente, (c) opiniones legislativas y (d) denuncia al Procurador General de la República sobre la constitucionalidad de las patentes concedidas por la vía pipeline.A seguir abordaremos brevemente estas acciones y sus principales desdoblamientos:
Los gastos con la compra del medicamento Kaletra® (asociación de los principios activos lopinavir y ritonavir), producido por el Laboratorio Abbott, representaba en 2005 aproximadamente un 30% de todo el gasto del Programa Nacional DST/AIDS con la compra de medicamentos. Este valor exorbitante llevó al gobierno brasileño a entrar en un proceso de negociación con Abbott con la intención de reducir el precio del medicamento.
Después de frustrados intentos de negociación, el entonces Ministro de Salud de Brasil declaró de interés público, en junio de 2005, la fabricación del Kaletra®. Esta declaración fue el primer paso para la concesión de una licencia obligatoria por interés público, ya que posibilitaría la producción nacional del referido medicamento, con un costo menor y transferencia de tecnología. En la época, Brasil pagaba por comprimido de Kaletra® U$S 1,17. Había una expectativa de que si fuera emitida la licencia obligatoria el producto podría ser producido por Farmanguinhos por U$S 0,41.42
Sin embargo, al mismo tiempo en que declaró el interés público del Kaletra®, el gobierno brasileño concedió un plazo adicional para que el Laboratorio Abbott ofreciera una disminución del valor cobrado por el medicamento, lo que evitaría la adopción del licenciamiento obligatorio. Así, en octubre de 2005 fue firmado un contrato entre el gobierno brasileño y el Laboratorio Abbott para la provisión del medicamento.43 El acuerdo, a pesar de representar una reducción en el precio cobrado por el medicamento, previó cláusulas contrarias al interés público nacional, tales como la obligatoriedad de no conceder la licencia obligatoria, el no suministro de cualquier asistencia de fabricación del medicamento y mantenimiento del precio estipulado hasta fines de 2011, cuando la patente del medicamento ya estaría cerca de expirar.
Tras la firma del acuerdo entre el gobierno y Abbott, organizaciones de la sociedad civil miembros del GTPI promovieron, en conjunto con el Ministerio Público Nacional, una acción civil pública inédita en Brasil contra el gobierno y contra Abbott demandando la emisión de una licencia obligatoria para el lopinavir/ritonavir. Una decisión favorable permitiría la producción local de una versión genérica del medicamento.44
Sin embargo, la medida provisional que fue solicitada al principio del proceso fue denegada bajo los argumentos de que la emisión de una licencia obligatoria generaría represalias por parte de los países desarrollados y posible falta de medicamentos, agravado esto por la ausencia de capacidad de producción nacional del medicamento. La medida provisional es una decisión que analiza el objeto de la acción, pero no representa una decisión final en el proceso.
Procurando combatir los argumentos empleados para la no concesión de la medida provisional en 2006, el GTPI, apoyado por la organización internacional Médicos Sin Fronteras (MSF), contrató especialistas nacionales e internacionales para evaluar la capacidad técnica de cuatro laboratorios nacionales (dos públicos y dos privados) para producir medicamentos antirretrovirales. Quedó comprobada la capacidad local de los laboratorios brasileños para producir antirretrovirales tanto de primera como de segunda línea.45 Estos resultados fueron también verificados en otros dos estudios concomitantes llevados a cabo en Brasil por la Fundación Clinton y por el Programa de las Naciones Unidas para el Desarrollo (PNUD). La producción nacional del medicamento supliría la demanda y hasta que el mismo fuera producido internamente podría ser importado de otros países en los que fuera comercializado por el laboratorio titular de la patente.
Estos argumentos fueron utilizados en la acción civil pública como forma de auxilio a la decisión final del juez en la acción, ya que la medida provisional que fue denegada es un pedido previo que no termina el proceso. La acción civil pública todavía está en etapa de instrucción y aguarda resolución.
También en 2006, organizaciones miembros del GTPI probaron usar canales administrativos para tratar de evitar que la oficina de patentes nacional (INPI) concediera patentes indebidas para medicamentos esenciales. De esta forma se presentaron dos observaciones al examen de patentes: la primera se refiere al pedido de una segunda patente para combinar lopinavir-ritonavir (Kaletra®) solicitada por Abbott y la segunda se refiere al pedido de patente para el fumarato de tenofovir disoproxil (Viread®) solicitado por Gilead.
La observación al examen de patente es una previsión contenida en la legislación brasileña de propiedad intelectual que permite a cualquier interesado que presente documentos e informaciones para auxiliar en el examen del pedido de patente en análisis en el INPI (artículo 31, LPI).
La presentación de observaciones al examen ante el INPI tuvo por objetivo ofrecer argumentos técnicos para que los pedidos de patente de los medicamentos antirretrovirales no fueran concedidos. Estos medicamentos tuvieron sus pedidos de patente cuestionados en base a distintos argumentos. En el caso del fumarato de tenofovir disoproxil, todas las sustancias descritas ya se encontraban reveladas en el estado de la técnica antes de la fecha de prioridad del pedido. El principio activo que actúa en el combate al SIDA es el tenofovir, conocido desde 1989, y los demás compuestos desarrollados no presentan ningún efecto técnico nuevo para un especialista en el tema, pues se trata de prácticas usuales empleadas en la síntesis orgánica. Por lo tanto, este pedido de patente de invención no presenta ninguna actividad inventiva.46
En el caso de la composición lopinavir/ritonavir, la empresa hizo un pedido de segunda patente (“patente de división”) para el producto. La primera patente ya fue concedida por el mecanismopipeline, dispositivo éste de la ley brasileña considerado por muchos juristas inconstitucional y que permitió la concesión de patentes sin la evaluación de los requisitos de patentabilidad previstos en ley. Sucede que no hay ninguna previsión legal para el requerimiento de división de pedidos de patentes pipeline. Por eso, al no responder a los requisitos de patentabilidad previstos en la legislación brasileña estos pedidos de patente no podrán ser concedidos por el INPI.
Asimismo, todavía en el campo de actuación referente a la concesión de patentes, a mediados de 2007, organizaciones del GTPI promovieron una acción de nulidad de patente en la cual cuestionaban la validez de una patente concedida a un kit de diagnóstico. Además de no ser permitida la concesión de patentes para kit de diagnóstico en Brasil, de acuerdo con un permiso contenido en los TRIP, la patente cuestionada fue concedida por el mecanismo pipeline, antes abordado.
Esta acción todavía está en su primera etapa en la Justicia y existen cuestionamientos sobre la legitimidad activa de las organizaciones de la sociedad civil para ingresar con este tipo de acción. En el caso de que sea reconocida la legitimada activa, el GTPI pretende promover otras acciones de este tipo cuestionando la legalidad de patentes concedidas indebidamente para insumos esenciales en Brasil.
Otra forma de actuación del GTPI consiste en hacer un seguimiento de proyectos de ley propuestos sobre el tema propiedad intelectual. Con esto se pretende evitar que se aprueben leyes que son contrarias al interés público evitándose grandes perjuicios posteriores. Se trata, así, de una estrategia de actuación preventiva.
En este sentido, destacamos dos casos en los que el GTPI actuó.
• inclusión de medicamentos antirretrovirales en la lista de materias no patentables;
• vinculación entre registro sanitario de un medicamento y expiración de los derechos de propiedad intelectual (linkage)
El primer caso se refiere al Proyecto de Ley 22/2003, el cual pretende incluir medicamentos ARV en el listado de materias no pasibles de protección patentaria en Brasil. En 2005, organizaciones miembros del GTPI enviaron a los diputados involucrados en el análisis del proyecto una opinión que apoya la aprobación del proyecto de ley (PL). El PL está en perfecta consonancia con los principios basilares de la Constitución de la República Federativa do Brasil, que brega para que prevalezca el derecho a la salud y a la vida frente a los derechos comerciales y eventuales intereses económicos de las empresas farmacéuticas. Además, responde a las reglamentaciones internacionales sobre el tema, ya que estas, aun reconociendo el derecho de propiedad industrial, establecen que los países en desarrollo, como Brasil, no sólo pueden sino que deben adoptar medidas que protejan la salud pública y aseguren el acceso a medicamentos para todos en casos extremos de epidemia, como el SIDA. El proyecto de ley obtuvo opinión favorable y todavía aguarda votación en la Cámara de Diputados.
La segunda opinión47 fue elaborada contra la aprobación del Proyecto de Ley 29/2006, que procura vincular la concesión del registro sanitario de un medicamento a la expiración de su respectiva patente. La opinión fue enviada a senadores y diputados ligados a cuestiones de salud. En la práctica, el vínculo entre patentes y registro sanitario establece una barrera adicional a la entrada de versiones genéricas en el mercado, ya que sólo permite iniciar el trámite del registro sanitario después de expirada la patente. O sea, retarda la promoción de la competencia de medicamentos, aunque estos estén fuera de protección patentaria, lo que es absolutamente contrario a la salud pública. En el caso de que este proyecto de ley sea aprobado, la excepción Bolar será excluida de la legislación brasileña. Ya hay una opinión favorable a archivar el proyecto de ley, pero todavía aguarda análisis de otras comisiones del Senado Nacional.
A fines de 2007, el GTPI presentó al Procurador General de la República una denuncia48 que demuestra la inconstitucionalidad de dos artículos de la legislación brasileña de propiedad intelectual, que crearon el mecanismo de concesión de patentes conocido como pipeline. La denuncia pide al Procurador General de la República que ingrese con una acción directa de inconstitucionalidad (ADIN) contra el mecanismo pipeline ante el Supremo Tribunal Federal, ya que organizaciones de la sociedad civil no poseen legitimidad para promover este tipo de acción.49
Una acción directa de inconstitucionalidad (ADIN) es un instrumento judicial que permite un control concentrado de constitucionalidad de una ley o acto normativo en el ámbito nacional, o sea, por medio de esta acción es posible cuestionar si determinada legislación –nacional o de los estados– está o no de acuerdo con la Constitución Nacional brasileña. La ADIN es juzgada directamente por el Supremo Tribunal Federal –tribunal máximo en Brasil– y la declaración de inconstitucionalidad resulta en retirar la norma cuestionada del ordenamiento jurídico e impedir que ésta produzca cualesquiera efectos.
Las patentes pipeline fueron concedidas durante el período de vacancia de la ley de propiedad intelectual brasileña, modificada en 1996. Hieren la Constitución Nacional por conceder protección patentaria a conocimientos que ya estaban en dominio público, violando el derecho adquirido de la colectividad. Además, hieren también las razones por las cuales la Constitución determinó protección a la propiedad intelectual: ya que no responden al interés económico y tecnológico del país. Así, no hay nada que justifique su concesión. Una opinión elaborada a pedido de los autores de la representación revela el perjuicio económico causado por las patentes pipeline, estimado en el orden de los miles de millones de dólares.
Este tipo de mecanismo de revalidación de patentes fue adoptado sólo en algunos pocos países además de Brasil, y en algunos de ellos como Ecuador, ya fue declarado incompatible con el sistema de protección a la propiedad intelectual adoptado internacionalmente.50
La denuncia tiene por objetivo que el Procurador General de la República proponga una ADIN o sea, el principal objetivo es demostrar que las patentes pipeline contrarían la Constitución Nacional brasileña. Sin embargo, se creyó que era relevante para el caso demostrar que las patentespipeline no forman parte del sistema internacional de protección a la propiedad intelectual y que, en ciertos puntos, son incompatibles con este sistema. Esta estrategia procuraba evitar que las reglas del sistema internacional de protección a la propiedad intelectual pudieran ser usadas como una traba al cuestionamiento de esas patentes ante el Poder Judicial brasileño, como ya ocurrió en el caso, antes relatado, de la no concesión de la medida provisional en la acción civil pública para la licencia obligatoria del Kaletra.
Así se demostró que el mecanismo pipeline no fue una exigencia de acuerdos adoptados por Brasil en el ámbito internacional y es hasta incluso incompatible con el Acuerdo TRIPS, la Convención de la Unión de París –CUP y el Tratado de Cooperación en Patentes– PCT de la Organización Mundial de Propiedad Intelectual.
Se recibieron cartas de organizaciones de la sociedad civil internacional especialistas en el tema que demuestran su apoyo a la acción del GTPI, además de reforzar los argumentos de la incompatibilidad de las patentes pipeline con el sistema internacional.51 Estas cartas de apoyo también demuestran la importancia de la acción en el escenario internacional, principalmente en relación al papel de liderazgo que Brasil ejerce en el ámbito internacional en cuestiones relacionadas con la propiedad intelectual y la salud pública.
De hecho, a lo largo de los últimos años, Brasil ha venido ejerciendo un importante papel de liderazgo para que las reglas de protección a la propiedad intelectual adoptadas en el ámbito internacional no pongan en riesgo los sistemas de salud pública en los países en desarrollo. Sin embargo, en el ámbito interno, la postura adoptada ha sido siempre la de hacer prevalecer los derechos de la propiedad intelectual sobre la salud pública, en flagrante contradicción con la postura adoptada por el país en foros internacionales. El cuestionamiento judicial de las patentespipeline, absolutamente contrarias al interés público, es un paso más en el camino de hacer prevalecer dentro de Brasil el discurso ya adoptado en la arena internacional.
Por último resaltamos que las patentes pipeline están lejos de ser un tema del pasado. Como ya se mencionó, centenas de pedidos de patente depositados por el pipeline todavía aguardan una decisión
del INPI. Muchos otros casos, en los cuales las patentes ya fueron concedidas y ya están cerca del final del plazo de protección, están en trámite en el Poder Judicial brasileño buscando la extensión de los plazos.52
La presentación de la denuncia fue a fines de diciembre de 2007 y se espera una audiencia con el Procurador General de la República para tratar el caso.
Son muchos los desafíos enfrentados por la sociedad civil para tratar de mantener las políticas de acceso universal a medicamentos por sobre las reglas de propiedad intelectual. Estos desafíos incluyen tanto la búsqueda de alternativas por dentro del actual sistema de patentes, forzando la implementación de las flexibilidades del Acuerdo TRIPS, como también el monitoreo de discusiones internacionales sobre el tema, especialmente sobre “innovación y acceso”, lo que implica la discusión de nuevos modelos de protección a la propiedad industrial.
La complejidad del tema y el tiempo necesario para seguir las discusiones constituyen importantes barreras a la participación de la sociedad civil en cuestiones que relacionadas al sistema de protección a la propiedad intelectual. En este sentido, la elaboración de materiales informativos con un lenguaje accesible y la demostración del impacto de este sistema en la vida cotidiana de las personas son esenciales para que el tema pueda ser captado por la sociedad. La realización de cursos de formación para activistas y organizaciones de la sociedad civil interesados directamente en el tema también se ha demostrado esencial en este sentido.
Las estrategias que vienen siendo propuestas por la sociedad civil brasileña revelan los importantes desafíos en el presente y para el futuro en los países en desarrollo, y pueden ser vistos desde tres ángulos: (a) perspectiva de producto por producto; (b) el sistema nacional de patentes; y (c) la necesidad de la reforma del sistema internacional de patentes. El primero está relacionado con el constante monitoreo de nuevos medicamentos que están siendo adoptados por el consenso terapéutico, así como de las barreras para el acceso a ellos. Se cree que es muy importante el fortalecimiento de la cooperación entre países en desarrollo, ya que probablemente enfrentarán los mismos problemas para los mismos medicamentos. El segundo está relacionado con el sistema nacional como un todo y con su impacto en las políticas de salud, como los casos ya mencionados. Esta perspectiva más amplia representa desafíos estructurales para la implementación constante de las políticas de salud. Finalmente, el más desafiante de todos los aspectos es reflexionar sobre una fuente alternativa para estimular el desarrollo de nuevos medicamentos sin pasar necesariamente por la apropiación intelectual, especialmente el sistema de patentes, que viene demostrando su carácter impeditivo al acceso de las poblaciones más vulnerables.
Se cree, por lo tanto, en la importancia del fortalecimiento de la sociedad civil y de la profundización de sus redes para que se pueda mejorar el intercambio de experiencias, el apoyo a los problemas nacionales, y la búsqueda de alternativas conjuntas contra los impactos negativos causados por las patentes en el acceso a la salud.
Por último, creemos que la vía judicial puede y debe ser utilizada como un canal en potencial para la defensa de derechos colectivos principalmente porque: (a) es una forma de hallar alternativas dentro del actual sistema de patentes en vigencia en Brasil; (b) es una forma de aumentar la atención pública sobre los impactos negativos de los derechos de propiedad intelectual en el acceso a la salud; (c) es una forma de estimular la participación e involucrar al Poder Judicial en la adopción de medidas que puedan presionar al Poder Ejecutivo para que implemente flexibilidades para la protección de la salud pública.
En relación a la implementación de las flexibilidades existentes, principalmente la licencia obligatoria, el reciente caso del efavirenz permitió un mayor avance de la percepción de cómo la sociedad en general se maneja con el tema. Al mismo tiempo en que hubo mucha presión en la gran prensa contra la licencia obligatoria emitida por el gobierno brasileño, muchos grupos pudieron apoyar el interés público y la importancia de la medida. Muchos grupos estuvieron presionando para que se implementaran las flexibilidades para la protección de la salud pública como parte de la agenda de movimientos VIH/SIDA y de salud. También hubo un gran apoyo internacional a la adopción de la licencia obligatoria.53
En este caso también hubo una demostración de que el gobierno brasileño está comprometido con el acceso universal al tratamiento y a la salud. A pesar de esto, algunos factores fueron esenciales para que el gobierno tomara esta medida: el importante precedente abierto por Tailandia al emitir una licencia obligatoria y la existencia de una oferta en el mercado farmacéutico internacional para proveer el medicamento licenciado. Esta oferta redujo la posibilidad de que el medicamento escaseara.
Sin embargo, esta no es una batalla terminada y existen muchas otras barreras que deben ser superadas. Ya es sabido que los costos de nuevos antirretrovirales están aumentando y su adquisición demanda la mayor parte del presupuesto del Ministerio de Salud. Cada vez más pacientes están haciendo uso de los medicamentos de segunda línea, medicamentos estos patentados en Brasil. Los medicamentos todavía más nuevos también están patentados en otros países en desarrollo productores de genéricos, como India. Así, en caso de emisión de una licencia obligatoria, no habrá ninguna otra oferta en el mercado para la provisión del medicamento más que la producción local del mismo.
Son muchos los desdoblamientos del tema y muchas las esferas que deben ser monitoreadas para que pueda haber un buen seguimiento de lo que ocurre no sólo en el ámbito nacional sino también en el ámbito internacional, ya que las decisiones tomadas en esta esfera impactan directamente en el sistema nacional. Además, también es importante estar al tanto de lo que ocurre en los sistemas nacionales de otros países en desarrollo, ya que es muy probable que ocurra lo mismo en Brasil.
En este sentido, es fundamental que haya un buen intercambio de informaciones y experiencias entre grupos que actúan en esta área, a fin de que se puedan construir estrategias conjuntas para enfrentar problemas similares y que las experiencias exitosas puedan ser adaptadas a los distintos contextos. Este es el objetivo primordial del presente artículo.
1. Brasil. Programa Nacional de DST/AIDS, Aids no Brasil. Disponible en: <www.aids.gov.br/data/Pages/LUMIS13F4BF21PTBRIE.htm>. Consultado: el 25 de oct. de 2007.
2. Brasil. Programa Nacional de DST/AIDS, Resposta + Brasilia, 2005. Disponible en: <http://www.aids.gov.br/data/documents/storedDocuments/%7BB8EF5DAF-23AE-4891-AD36-1903553A3174%7D/%7BEE03B6A9-6598-423D-BCF9-D41DBFC04408%7D/resp-posit01web.pdf>. Consultado: el 21 de enero de 2008.
3. Organización Mundial de la Salud (OMS). Progress on global access to HIV antiretroviral therapy: a report on ‘3 by 5’ and beyond., Geneva, 2006. Disponible en: <http://www.who.int/hiv/fullreport_en_highres.pdf>. Consultado: el 30 de oct. de 2006.
4. Brasil. Programa Nacional de DST/AIDS, Sistema de Monitoreo de Indicadores. Disponible en: <http://sistemas.aids.gov.br/monitoraids2/abrir.asp?valor=234>. Consultado: el 22 de enero de 2008.
5. Consulta realizada por correo electrónico al Programa Nacional de DST/AIDS el 15 de agosto de 2007.
6. Brasil. Coordenação-Geral de Ações de Suporte às Ações de Assistência Farmacêutica – CGSAF/DAF/SCTIE, apud GRECO, Dirceu B. Desafios da epidemia de Aids após 10 anos de terapia anti-retroviral. 2007. Disponible en: <http://www.aids.gov.br/data/documents/storedDocuments/%7BA07528E1-7FB7-4CC7-97AD-B7CB17C9CA85%7D/%7B73A9984F-4F25-4E3D-AA91-10E82E30A86E%7D/ADESAO-01GrecoBrasilia-19-06-07%20%20%2003.pdf>. Consultado: el 22 de enero de 2008.
7. En este sentido ver: Brasil. Programa Nacional de DST/AIDS, A sustentabilidade do acesso universal a anti-retrovirais no Brasil. Brasilia, 2005. Disponible en: <http://www.aids.gov.br/data/documents/storedDocuments/%7BB8EF5DAF-23AE-4891-AD36-1903553A3174%7D/%7B0938AD30-E212-4E08-AE96-7C96622C85A3%7D/Cons._nacional_sustentabilidade.doc>. Consultado: el 21 de enero de 2008.8. K inzo, M.A.G. A democratização brasileira – um balanço do processo político desde a transição. São Paulo em Perspectiva, San Pablo, v.15, n. 4, oct/dic., 2001.
9. ESCOREL, S. Reviravolta na saúde. Origem e articulação do movimento sanitário. Río de Janeiro: Fiocruz, 208 p.,1999.
10. Brasil. Programa Nacional DST/AIDS. História do Programa Nacional – AIDS vinte anos – esboço histórico para entender o programa brasileiro. Disponible en: <http://www.aids.gov.br>. Consultado: el 27 de feb. de 2007.
11. Idem.
12. SCHEFFER, M.; SALAZAR, A. & GROU, K. O remédio via justiça – um estudo sobre o acesso a novos medicamentos e exames em HIV/Aids no Brasil por meio de ações judiciais. Brasília: Ministério da Saúde, 136 p., 2005.
13. OLIVEIRA M.A. & ESHER, A. Acesso universal ao tratamento para as pessoas vivendo com HIV/Aids no Brasil. In: BERMUDEZ, J.A.Z.; OLIVEIRA, M.A. & ESHER, A. (orgs.). Acceso a medicamentos: derecho fundamental, papel del Estado. Rio de Janeiro: ENSP/Fiocruz, 2004, p. 233-250.
14. Associação Brasileira Interdisciplinar de Aids – ABIA. Patentes: por que o Brasil paga mais por medicamentos importantes para a saúde pública?, 2006. isponible en: . Consultado: el 22 de enero de 2008.
15. Organización Mundial del Comercio (OMC). Glossário y Fact sheet: TRIPS and pharmaceutical patents – obligations and exceptions . Disponibles en: . Consultado: el 21 de enero de 2008. Traducción nuestra.
16. CHAVES, G.C. e OLIVEIRA, M.A. A proposal for measuring the degree of public health–sensitivity of patent legislation in the context of the WTO TRIPS Agreement. Bulletin of the World Health Organization, v. 85, n. 1, 2007, p. 49-56.
17. CHAVES, G.C. Patentes farmacêuticas: por que dificultam o acesso a medicamentos?. Río de Janeiro: ABIA, 2006. Disponible en: <http://www.abiaids.org.br/cedoc/publicacoes>. Consultado: el 22 de enero de 2008.
18. Idem.
19. LIMA, L. C. W. Coordenador de propriedade intelectual da ANVISA. Disponible en: <http://comvisa.anvisa.gov.br/tiki-read_article.php?articleId=80&PHPSESSID= e40a0286138454e3702a6bec26c8ae07>. Consultado: el 22 de enero de 2008.
20. Tailandia. Ministry of Public Health and the National Health Security Office. Facts and evidences on the ten burning issues related to the government use of patents on three patented essential drugs in Thailand, 2007. Disponible en: <http://www.moph.go.th/hot/White%20Paper%20CL-EN.pdf>. Consultado: el 3 de mayo de 2007.
21. KIJTIWATCHAKUL, K. The right to health. Thailand: Medecins Sans Frontiéres-Belgium (MSF-B), Pharmacy network for Health Promotion (PNHP), Thai health Promotion Foundation and Third World Network, 2007.
22. FORD, N.; WILSON, D.; CHAVES, G.C.; LOTROWSKA, M. & KIJTIWATCHAKUL, K. Sustaining access to antiretroviral therapy in the less-developed world: lessons from Brazil and Thailand. AIDS. London, v. 21, supl 4: S21-S29, Julho 2007.
23. En este sentido ver estudio realizado por Knowledge Ecology International (KEI). Recent examples of the use of compulsory licenses on patents . Disponible en: <http://www.keionline.org/misc-docs/recent_cls.pdf>. Consultado: el 22 de enero de 2008.24.BERMUDEZ, J.A. Z. ; OLIVEIRA, M.A. & CHAVES, G.C. O Acordo TRIPS da OMC e os desafios para a saúde pública. In: BERMUDEZ, J.A.Z.; OLIVEIRA, M.A. & ESHER, A. (orgs.), op.cit.; p. 69-90.
25. GRANJEIRO, A.; TEIXEIRA, L.; BASTOS, F.I. e TEIXEIRA, P. Sustainability of Brazilian policy for access to antiretroviral drugs. Revista de Saúde Pública, São Paulo, v. 40 (supl.), 2006. . Disponible en: <http://www.scielo.br/pdf/rsp/v40s0/en_09.pdf>. Consultado: el 22 de enero de 2008.
26. Grupo de Trabajo de Propiedad Intelectual (GTPI). Acordo do governo brasileiro com a Abbot frustra expectativas dos brasileiros, 13 de jul. de 2005. Disponible en: <http://www.rebrip.org.br/_rebrip/pagina.php?id=659>. Consultado: el 10 de enero de 2008.
27. CHAVES, G.C. Perguntas e respostas sobre o licenciamento compulsório do medicamento Efavirez no Brasil. Río de Janeiro: ABIA, 2007. Disponible en: <http://www.abiaids.org.br/cedoc/publicacoes/artigos.aspx?lang=pt&mid=6&smid=2&siid=7&fg= Materias%20Informativos>. Consultado: el 21de enero de 2008.
28. BRASIL. Chega ao Brasil 1º lote de efavirenz genérico usado no tratamento da AIDS. Brasília, Radiobrás, 02 de julho de 2007. Disponível em http://www.agenciabrasil.gov.br/noticias/2007/07/02/materia.2007-07-02.7585739203/view>. Consultado: el 20 de marzo de 2008. El valor pago por comprimido de uso adulto (600mg) fue de R$ 1. Cada adulto hace uso de 1 comprimido por día, totalizando un costo de R$ 365 paciente/año o US$ 190 paciente/año (considerando la tasa de conversión oficial de R$1.91 para 1 USD, vigente en el día del recibimiento del lote).
29. Brasil.Discurso del presidente de la República, Luiz Inácio Lula da Silva, en la ceremonia de firma del acto de licenciamiento obligatorio del medicamento efavirenz. Palácio do Planalto, Brasilia, 4 de mayo de 2007. Disponible en: <http://www.imprensa.planalto.gov.br/download/discursos/pr128-2.doc>. Consultado: el 22 de enero de 2008.
30. “Estado de la técnica o estado del arte es toda la información tecnológica a disposición del público en Brasil o en el exterior, por descripción escrita u oral, por uso o cualquier otro medio, antes de la fecha del depósito de la patente o del modelo de utilidad (art. 11, § 1º de la LPI).”
31. BARBOSA, Denis B. Pipeline: uma inconstitucionalidade patente. Disponible en: <http://denisbarbosa.addr.com/27.rtf >. Consultado: el 3 de dic. de 2007.
32. De acuerdo con el artículo 4 de la Convención de la Unión de París – CUP, quien esté presentando un pedido de patente de invención en un determinado país tendrá un plazo de 12 meses para presentar el mismo pedido en otros países. Este plazo se conoce como “período de prioridad”.
33. Idem.
34. Conforme consulta realizada en el Banco de Patentes del Instituto Nacional de Propiedad Industrial en oct. de 2007. Disponible en: .
35. BERMUDEZ, J. A. Z.; EPSZTEJN, R.; OLIVEIRA, M.A. & HASENCLEVER, L. O acordo TRIPS da OMC e a proteção patentária no Brasil: mudanças recentes e implicações para a produção local e acesso da população aos medicamentos. Rio de Janeiro: Ensp-Fiocruz/OMS, 2000, p. 131.
36. CORIAT, B.; ORSI, F. & d’ALMEIDA, C. TRIPS and the international public health controversies: issues and challenges. Industrial and Corporate Change Advance Access, nov. 2006, p. 1-30.
37. Brasil. Instituto Nacional de Propriedade Intelectual (INPI). Disponible en: <http://www.inpi.gov.br/menu-esquerdo/patente/pasta_manual/DiretrizesQuimica.pdf/view?searchterm=diretrizes>. Consultado: el 22 de enero de 2008.
38. DRAHOS, P. Bilateralism in intellectual property. Report commissioned by Oxfam GB as part of its Cut the Cost of Medicines Campaign . OXFAM, 2001. isponible en: <http://www.oxfam.org.uk/what_we_do/issues/trade/downloads/biltateralism_ip.rtf>. Consultado: el 25 de enero de 2008.
39. Para más informaciones ver .
40. Nacionales: ABIA, GIV, GAPA-SP, GAPA-RS, GESTOS, GRAB, Pela Vidda-SP, Idec, Conectas Direitos Humanos, RNP+ Maranhão, Federación Nacional de Farmacéuticos. Internacionales: Oxfam, Médicos Sin Fronteras.
41. ABIA. Patentes farmacêuticas: por que dificultam o acesso a medicamentos?, 2006. Disponible en: <http://www.abiaids.org.br/_img/media/cartilha_patentes.pdf>. Consultado: el 21 de enero de 2008. ABIA. perguntas e respostas sobre o licenciamento compulsório do medicamento Efavirenz no Brasil, 2007. Disponible en: <http://www.abiaids.org.br/_img/media/EFAVIRENZ.pdf>. Consultado: el 21 de enero de 2008. ABIA. Propriedade intelectual: interfaces e desafios, 2007. Disponible en: <http://www.abiaids.org.br/_img/media/Anais_Rebrip_web.pdf>. Consultado: el 21 de enero de 2008.
42. Agência Nacional da Aids.Técnicos da Saúde, Indústria e Comércio analisaram proposta da Abbott referente ao Kaletra, 19 de agosto de 2005. Disponible en: <http://sistemas.aids.gov.br/imprensa/Noticias.asp?NOTCod=66822>. Consultado: el 10 de enero de 2008.
43. Brasil. Ministerio de Salud, Acordo entre o Ministério da Saúde e o Laboratório Abbott. Disponible en: <http://www.aids.gov.br/data/documents/storedDocuments/%7BB8EF5DAF-23AE-4891-AD36-1903553A3174%7D/%7B132F255F-85A2-4939-8626-0BB7EE507C72%7D/AIDS.BR_.pdf>. Consultado: el 21 de enero de 2008.
44. REIS, R. Patentes farmacêuticas, acesso e produção de ARVs. Boletim ABIA, Río de Janeiro, agosto-oct. 2006.
45. FORTUNAK, J. M. & ANTUNES, O.A.C. A produção de ARV no Brasil – uma avaliação. Río de Janeiro: ABIA/MSF, 2006. Disponible en: <http://www.abiaids.org.br/media/ARV.pdf>. Consultado: el 22 de enero de 2008.
46. ABIA. Patentes: por que o Brasil paga mais por medicamentos importantes para a saúde pública?. 2ª edición revisada, 2006. Disponible en: <http://www.abiaids.org.br/_img/media/patentes_GTPI.pdf>. Consultado: el 21 de enero de 2008.
47. REBRIP. Parecer del Grupo de Trabajo sobre Propiedad Intelectual-Rebrip, Projeto de Lei 29 de 2006, proposto por el ex-Senador Ney Suassuna PMDB/PB). Opinión disponible en: <http://www.deolhonaspatentes.org.br/media/file/Proj_Leis/PL29_manifestacao_gtpi_rebrip.pdf>. Consultado: el 21 de enero de 2008.
48. Denuncia completa disponible en la página electrónica de Conectas Direitos Humanos: CONECTAS DIREITOS HUMANOS. Organizações contestam a constitucionalidade da Lei de Propriedade Intelectual, 29 de nov. De 2007. Disponible en: <http://www.conectas.org/noticia.php?not_id=192>. Consultado: el 22 de enero de 2008.
49. Están legitimados para proponer una acción directa de inconstitucionalidad, según el artículo 103 de la Constitución Nacional: el Presidente de la República; la Mesa del Senado Nacional; la Mesa de la Cámara de Diputados; la Mesa Directiva de la Asamblea Legislativa o de la Cámara Legislativa del Distrito Federal; Gobernadores de Estado o del Distrito Federal; el Procurador-General de la República; el Consejo Nacional del Colegio de Abogados de Brasil; partidos políticos con representación en el Congreso Nacional; confederaciones sindicales o entidades sectoriales de alcance nacional.
50. EQUADOR. Tribunal de Justicia de la Comunidad Andina, Proceso 1/AI/96, 30 de oct. De 1996. Decisión disponible en: http://intranet.comunidadandina.org/Documentos/Procesos/1-AI-96.doc>. Consultado: el 15 de dic. de 2007.
51. Hasta la redacción de la versión final de este artículo en enero de 2008, los grupos e investigadores que enviaron cartas de apoyo fueron: 1 – Fundación IFARMA – Colombia; Oxfam International; Thai network of people living with HIV/AIDS; (TNP+); AIDS ACCESS Foundation; Thai Foundation for consumers; Thai Rural Doctors society; Thai Chronic renal failure network; Thai Alternative Agriculture network; Thai Parents network; Thai Rural Pharmacist society; Thai NGOs Coalition on AIDS; FTA Watch; Drug Study Group; Prof. Kevin Outterson (Boston University School of Law); Prof. Brook K. Baker (Northeastern University School of Law); Knowledge Ecology International (KEI); Third World Network; Lawyers Collective HIV/AIDS Unit; Indian Network for People Living with HIV/AIDS; Delhi Network of Positive People; Alternative Law Forum; Cancer Patients Aid Association y ActionAID India.
52. Conforme consulta del proceso realizada en los Tribunales Regionales Federales en nov. de 2007.
53. Petitorio de apoyo a la Licencia Obligatoria del Medicamento Efavirenz en Brasil. Disponible en: <http://www.agenciaaids.com.br/arquivos/lista_abia.doc>. Consultado: el 21 de enero de 2008.